A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חדירה חקלאית כפויה בוואקום עבור בצמח טרנספורמציה של צמחים סרבנים: קקאו כמקרה בוחן
In This Article
Summary
כאן, אנו מציגים את הפרוטוקול הראשון לחדירת ואקום מקומית למחקרי in vivo של טרנספורמציה גנטית של צמחים גדולים. באמצעות מתודולוגיה זו, השגנו לראשונה את הטרנספורמציה הארעית של קקאו בתיווך אגרובקטריום בפלנטה .
Abstract
חולף בטרנספורמציה של צמח הוא חלופה מהירה וחסכונית לשינוי גנטי של צמחים. רוב הפרוטוקולים לטרנספורמציה של צמחים מסתמכים על שימוש בטרנספורמציה בתיווך אגרובקטריום. עם זאת, הפרוטוקולים הנמצאים בשימוש כיום הם סטנדרטיים עבור צמחים בגודל קטן בשל האילוצים הפיזיים והכלכליים של הגשת צמחים גדולים לטיפול ואקום. עבודה זו מציגה פרוטוקול יעיל לחדירה חקלאית מקומית מבוססת ואקום המותאמת לצמחים גדולים. כדי להעריך את יעילות השיטה המוצעת, בדקנו את השימוש בה בצמחי קקאו, מין צמח טרופי הסרבן לשינוי גנטי. הפרוטוקול שלנו איפשר להחיל ואקום של עד 0.07 מגפ"ס, עם חזרות, על חלק אווירי מקומי של עלי קקאו, מה שאיפשר לכפות חדירה של אגרובקטריום לחללים הבין-תאיים של עלים מחוברים. כתוצאה מכך, השגנו את הארעי בתיווך אגרובקטריום בטרנספורמציה צמחית של עלי קקאו מחוברים המבטאים עבור מערכת הכתבים של רובי. זהו גם האגרובקטריום הראשון בתיווך בטרנספורמציה חולפת של צמח הקקאו. פרוטוקול זה יאפשר ליישם את שיטת ההסתננות החקלאית מבוססת הוואקום על מיני צמחים אחרים בעלי מגבלות גודל דומות ויפתח את הדלת לאפיון גנים במינים עציים וגדולים סרבנים.
Introduction
שיטות טרנספורמציה גנטית של צמחים חיוניות לבדיקת התפקודים הביולוגיים של גנים והן שימושיות במיוחד כיום בהתחשב במספר הרב של גנים לא מאופיינים שנחזו בעידן הפוסט-גנומי1. שיטות אלה יכולות לשמש להשגת קווים מותמרים במלואם או לבטא גנים באופן ארעי. טרנספורמציה יציבה מתרחשת כאשר הדנ"א הזר שהפונדקאי קלט משתלב באופן מלא ובלתי הפיך בגנום המארח, והשינויים הגנטיים מועברים לדורות הבאים. ביטוי חולף, המכונה טרנספורמציה חולפת, מתרחש מעותקים מרובים של T-DNA המועברים על ידי אגרובקטריום לתוך התא, שלא שולבו בגנום המארח, ומגיע לשיאו 2-4 ימים לאחר ההדבקה2.
ראוי לציין כי מבחני ביטוי חולפים מספיקים לעתים קרובות לאפיון פונקציונלי של גנים ויכולים להציע מספר יתרונות על פני טרנספורמציה יציבה. לדוגמה, טרנספורמציה חולפת אינה דורשת הליכי התחדשות מבוססי תרבית רקמות. יתרון נוסף הוא שהוא תואם בניתוח פונקציונלי של גנים, קיים מספר דוגמאות מוצלחות של פרוטוקולים מתוקננים היטב עבור מיני צמחי מודל, כגון Arabidopsis thaliana3 ו - Nicotiana benthamiana4, אך עדיין מוגבל במינים שאינם מודל5.
פיתוח בדיקות ארעיות מסתמך על זמינותן של שיטות יעילות להעברת גנים. לשם כך, הגישות הפופולריות ביותר מבוססות על חדירת אגרובקטריום , המנצלת את יכולתו הייחודית של אגרובקטריום להעביר דנ"א לתאי צמח6. כלי שימושי נוסף לניתוחים אלה הוא השימוש בגנים עיתונאיים, כגון חלבונים פלואורסצנטיים ירוקים (GFP), β-glucuronidase (GUS), luciferase או RUBY, שכולם משמשים למעקב אחר אירועי טרנספורמציה. מבין מערכות הכתבים הללו, RUBY היא כיום הקלה ביותר לדמיון ומסתמכת על המרה של טירוזין לבטאלינים באמצעות שלוש תגובות שלב אנזימטיות. בניגוד למערכות דיווח אחרות, ניתן להבחין בקלות בבטאלינים המתקבלים כפיגמנטים צבעוניים בהירים על רקמת צמח שעברה טרנספורמציה ללא צורך בציוד מתוחכם או מגיבים נוספים7.
כאשר חודרים תרחיף אגרובקטריום לחלל הבין-תאי של מזופיל העלה, הצעד הקריטי ביותר לזיהום חקלאי מוצלח הוא התגברות על המחסום הפיזי המוטל על ידי הקוטיקולה האפידרמית של העלים8. בעוד שעבור צמחים מסוימים, שיפוע לחץ שנוצר באמצעות מזרק ללא מחט (מזרק Agroinfiltration) מספיק לחדירה חקלאית יעילה, כפי שקורה ב- Nicotiana benthamiana9, מיני צמחים אחרים עשויים לדרוש שיפוע לחץ גדול יותר כמו זה שנוצר בעזרת משאבות ואקום10. בתהליכים בסיוע ואקום, חדירה חקלאית מתרחשת בשני שלבים. בראשון, ואקום משמש כדי לחשוף את החומר הצמחי ללחץ מופחת, לאלץ שחרור של גזים מחללי האוויר מזופיל דרך פיוניות ופצעים. לאחר מכן, בשלב ההדחקה, תרחיף אגרובקטריום חודר לחללים הבין-תאיים דרך הפיוניות ופוצע11.
בהשוואה לחדירת מזרקים, חדירת ואקום מאפשרת תדירות שימוש גבוהה יותר, חזרתיות ויכולת שליטה בלחץ ובמשך בכל שלב בתהליך החדירה10. בעלים של מיני צמחים שונים כגון תרד (Spinacia oleracea)12, אדמונית (רב-שנתית עצית) (Paeonia ostii)13, ופרווה (Vigna unguiculata)14, פרוטוקולי חדירת ואקום השיגו שיעור חדירה עמוק יותר מאשר חדירת מזרקים. באופן דומה, בעגבניות (Lycopersicon esculentum)15, ובגרברה (Gerbera hybrida)16, חדירת ואקום יצרה השתקת גנים חזקה ואחידה יותר מאשר חדירת מזרקים. יתרון נוסף של חדירת ואקום הוא התלות הנמוכה יותר בגנוטיפ, בהשוואה לחדירת מזרקים, שנצפתה לאחרונה בשלושה זני הדרים (Fortunella obovata, Citrus limon ו-C. grandis)17. עם זאת, כאשר מנסים להחיל חלחול ואקום על צמחים גדולים מכדי להתאים לחומרי ניקוי, גודל תאי הוואקום יכול להוות מגבלה, כפי שקורה בדרך כלל עם צמחים עציים טרופיים.
להלן, אנו מתארים פרוטוקול המתגבר על המגבלה המרחבית של תאי ואקום, ובודק את התועלת שלו עבור טרנספורמציה חולפת של עלי קקאו. אנו מציגים את שיטת חדירת הוואקום המקומית הראשונה לקקאו, שאינה דורשת ציוד נוסף ואף מאפשרת שימוש באותם מייבשי מעבדה המשמשים לחדירה של הצמח כולו, אך עם התאמה פשוטה המאפשרת גישה לחלק מהצמח בתוך תא הוואקום, ומאפשרת את השימוש בו בשלבים שונים של התפתחות הצמח. כדי לבחון את התועלת של שיטת חדירת הוואקום המקומית המוצעת, בחרנו בקקאו כייצוג של מיני צמחים טרופיים בעלי עלים גדולים שקשה לשנות אותם. באמצעות שיטת חדירה מקומית זו, דיווחנו לאחרונה על ביטוי חולף ראשון בצמח באבוקדו על ידי חדירת ואקום בתיווך אגרובקטריום בתנאים שהותאמו בעבר לעלים מנותקים18, וכאן אנו מדווחים על ביטוי חולף ראשון בצמח בקקאו.
Protocol
1. תרבות Agrobacterium tumefaciens
- הפשירו תאים אלקטרוכשירים של זן Agrobacterium tumefaciens LBA4404.
- הוסף 1 מ"ל של מאלט שמרים (YM; טבלה 1) ציר לצינור תרבית בגודל 17 מ"מ x 100 מ"מ. שמור צינור זה למועד מאוחר יותר, ושמור אותו בטמפרטורת החדר (RT).
- בצינור מיקרופוגה של 1.5 מ"ל, הוסף 30 μL של תאי אגרובקטריום מופשרים ו- 100-250 ng (עד 5 μL) של ה- DNA המכיל 35S:RUBY. מערבבים בעדינות.
הערה: 35S: RUBY היה מתנה מ Yunde Zhao. כדי למנוע קשת דגימה, להפחית את נוכחותם של תרכובות יוניות ככל האפשר. תרכובות יוניות אלה עשויות להיות שאריות מלחים ממשקעי אתנול של DNA19. - בשלב זה, הניחו קובטת אלקטרופורציה בקוטר 1 מ"מ על קרח.
- מעבירים את תערובת המתלים הקודמת לקובט אלקטרופורציה מקורר בקוטר 1 מ"מ. שמור הכל על קרח. נגבו את האלקטרודות המתכתיות של הקובט.
- הגדר את האלקטרופורטור ל - Agr (2.2 kV, ~ 5 אלפיות השנייה, פעימה אחת). מניחים את הקובט בתוך תא האלקטרופורציה.
- לחצו על כפתור הדופק . רשום את פרמטרי הדופק. אם הדגימה הייתה מקושתת, תהליך האלקטרופורציה נכשל.
הערה: חיוני להעביר במהירות את התאים לציר YM מיד לאחר הדופק. עיכוב העברה זו יכול להפחית באופן דרמטי את יעילות השינוי20. - באופן מיידי, השתמש במרק YM שנשמר כדי להעביר את התאים מהקובטה לצינור בגודל 17 מ"מ x 100 מ"מ. השהה מחדש את התאים בעדינות.
- לדגור על התאים שעברו טרנספורמציה במשך 3 שעות ב 28 ° C ו 250 סל"ד על אינקובטור מסלולי.
הערה: בתרבית זו אין אנטיביוטיקה; היזהר לגבי תנאים אספטיים נאותים. - פזרו תרבות זו על צלחות אגר סלקטיביות של YM21. עבור זן LBA4404-RUBY שעבר טרנספורמציה, ודא שהלוחות האלה מכילים ריפמפיצין (25 מיקרוגרם/מ"ל), ספקטינומיצין (50 מיקרוגרם/מ"ל) וסטרפטומיצין (50 מיקרוגרם/מ"ל). דוגרים על צלחת זו למשך הלילה באינקובטור עומד של 28 מעלות צלזיוס.
הערה: בפרוטוקול זה נעשה שימוש בווקטור 35S:RUBY , המקנה עמידות חיידקית לספקטינומיצין (50 מיקרוגרם/מ"ל) ומתפקד ככתב חזותי על רקמת צמח שהסתננה. - לחסן מושבות מתרבות הלילה על 12.5 מ"ל של תערובת של מרק YM ו Luria Bertani (LB) מרק (ביחס 9: 1, בהתאמה), 10 mM של MES, pH 5.722. ודא כי תווך נוזלי סלקטיבי זה מכיל את אותה אנטיביוטיקה המשמשת בשלב 1.10. עיין בטבלה 1 כדי לראות את המרכיבים והריכוזים עבור מדיומים אלה.
- בעת הדגירה Agrobacterium, להשאיר מספיק מקום אוורור עבור התרבית, בערך 4 עד 5 פעמים נפח נוזלי. השתמשו בציר YM לזן אגרובקטריום LBA4404 כדי למנוע הצטברות תאים23.
- לדגור את התרבית במשך 16 שעות ב 250 סל"ד על אינקובטור מסלול 28 מעלות צלזיוס.
- שנה את קנה המידה של התרבית עד פי 10 מהנפח הראשוני עם אותו מדיום המשמש בשלב 1.11.
- לדגור את התרבית במשך 16 שעות ו 250 סל"ד על אינקובטור אורביטלי 28 מעלות צלזיוס.
- התאם את תרבית הלילה לצפיפות אופטית (OD600) של 0.4. הוסף 20 מיקרומטר של אצטוסירינגון (AS).
- דוגרים ב-250 סל"ד על אינקובטור אורביטלי של 28 מעלות צלזיוס עד ש-OD600 מגיע לכ-1.0.
- צנטריפוגה את התאים ב 4 500 x גרם במשך 10 דקות ב 20 ° C.
- השהה מחדש את הגלולה עם פתרון השעיה (10 mM MES, 10 mM MgCl2, pH 5.7), התאמת OD600 ל 0.6. הוסף 200 מיקרומטר AS24.
הערה: יש לדגור מראש על תמיסת ההשעיה ב-28°C. אם תמיסת ההשעיה קרה בעת הוספתה, התאים יזרזו. - השאירו את התרחיף החיידקי למשך 2-24 שעות בתנאים חשוכים ו-25 מעלות צלזיוס. אין צורך בתסיסה22.
2. בחירת צמחים
- בחר צמח עם ענף עם עלים בשלב האופטימלי עבור agroinfiltration.
הערה: הצמח עשוי להיות עץ בוגר או בוגר. עבור קקאו, עלים צעירים של שלב C מומלץ. עלים אלה בצבע ברונזה עד ירוק בהיר; הם אינם מורחבים במלואם ואינם נוקשים כמו שלב D משאיר25 (איור 1).- כבקרה, לבצע בו זמנית חדירה חקלאית על צמחים אחרים (למשל, Nicotiana tabacum) עם יעילות גבוהה agroinfiltration כי הוא דיווח עבור הזן וקטור בשימוש.
הערה: אם לא מתקבלות תוצאות חיוביות בבקרה זו, ייתכן שהתוצאות השליליות נובעות מהמתח או מהווקטור שבו נעשה שימוש.
- כבקרה, לבצע בו זמנית חדירה חקלאית על צמחים אחרים (למשל, Nicotiana tabacum) עם יעילות גבוהה agroinfiltration כי הוא דיווח עבור הזן וקטור בשימוש.
3. הגדרת תא ואקום
- כתא ואקום, השתמש במייבש שיש לו מד ואקום כדי למדוד את לחץ הוואקום שבתוכו.
- הוסף 250 מיקרומטר של חומצה יסמונית (JA)18,26 לתרחיף אגרובקטריום משלב 1.19.
- מעבירים את תרבית האגרובקטריום לכוס רחבה כדי לטבול את הענף והעלים שנבחרו. לאחר מכן, הניחו את הכד עם תרבית אגרובקטריום בתוך המייבש.
- מניחים את הענף בין מייבש הכביסה למכסה שלו. הקפידו לטבול את העלים הרצויים בתוך תרבית אגרובקטריום . לאחר מכן, השתמשו בטבעת קפיצה, שהיא טבעת עגולה עם מגרעת המאפשרת לענף הצמח להיכנס למייבש. טבעת הקפיצה משמשת גם כמרווח בין החלק התחתון והעליון של המייבש.
- ודאו שהאטם יציב מספיק מבחינה מבנית כדי למנוע מעיכה עם המכסה, גמיש מספיק כדי להתכופף ולהסתגל להיקף המייבש, ולא עשוי מחומר נקבובי.
הערה: במחקר זה נעשה שימוש בחוט מתכת תקוע המורכב מכמה חוטים קטנים יותר המעוותים יחד, מצופים בחומר פלסטי לא נקבובי הדומה לאטם (איור 2). - כדי לקבע את הענף על המייבש, השתמש בחומר רושם סיליקון. ודאו שהחומר דביק, לא נקבובי, אינרטי כימית למייבש ולמפעל, וקל ליישום ולמילוי רווחים קטנים בין הענף, האטם והמייבש.
- לאחר שחומר הסיליקון מתפלמר (זה לוקח בערך דקה) ומקבע את הענף במקומו, סוגרים את המייבש. הקפידו לא להשאיר פערים.
- חברו את מייבש הכביסה למשאבת הוואקום (איור 3).
4. חדירת ואקום
- הפעל את משאבת הוואקום עד שהיא מגיעה ל -0.07 MPa.
- ברגע שהוא מגיע ללחץ זה, סגור את שסתום הלחץ וכבה את משאבת הוואקום. שמרו על לחץ זה למשך 5 דקות.
- פתח את שסתום הלחץ כדי לשחזר את לחץ התא.
הערה: זהו שלב קריטי. לשחזר את לחץ החדר בהדרגה ובהתמדה. זה עשוי לקחת עד 3 דקות כדי לדכא באופן מלא את מייבש. לחץ חוזר ממושך מגדיל את מספר החיידקים החודרים לתוך הרקמה10. - חזור על תהליך זה פעמיים נוספות.
- מורידים את הענף ממתלה התא ומייבש.
- נקו את העלים המסתננים במים מזוקקים.
5. דגירה של עלים מסתננים
- תנו לעלים המסתננים להישאר בתנאים חשוכים ב 25 מעלות צלזיוס במשך 48 שעות.
- לאחר מכן, חשוף את הרקמה המוחדרת לפוטופריוד בהיר/כהה של 16/8 שעות.
- להעריך את שינוי העלה הארעי 3-7 ימים לאחר ההדבקה (DPI).

איור 1: עלי קקאו בשלבי התפתחות. (A-E) שלבי התפתחות25. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
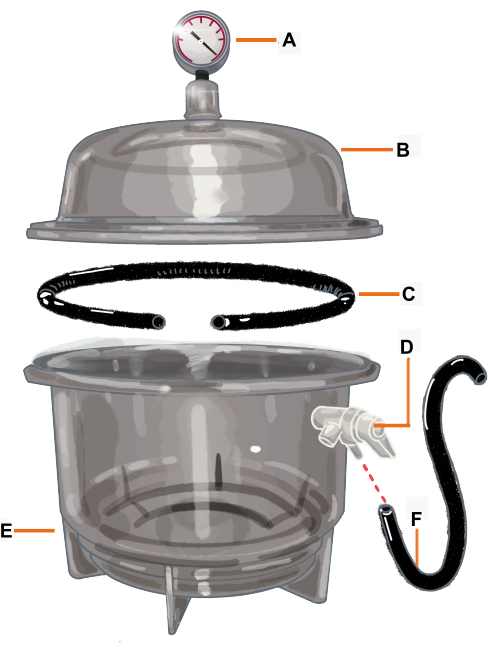
איור 2: תצורת תא ואקום ומרכיביו. תא הוואקום הוא מייבש המחובר למדיד ואקום. האטם/טבעת ה-O נחתכת כך שיש לה פתח בו ימוקם הענף. (A) מד ואקום, (B) מכסה, (C) אטם/ O-ring, (D) שסתום לחץ, (E) מייבש, (F) צינור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: במערכת חדירת ואקום של צמחים . כדי למנוע אובדן ואקום במהלך תהליך החדירה, קריטי לאבטח את הענף למייבש ולאטם/טבעת O עם חומר רושם סיליקון. (A) צמח קקאו, (B) תא ואקום, (C) חומר רושם סיליקון, (D) עלים שקועים בתרחיף Agrobacterium , (E) משאבת ואקום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
פרוטוקול זה מציג שיטת חדירה חקלאית יעילה לצמחים עציים גדולים. בעזרת פרוטוקול זה, הצלחנו להשיג לחץ ואקום של -0.07 MPa, וכתוצאה מכך חדירה יעילה ומקומית של עלי קקאו. באיור 4 אנו צופים בתהליך הקמת מערכת החדירה, ובאיור 5 בתצורה הסופית.
Discussion
בעבודה זו הצגנו פרוטוקול יעיל ובעלות נמוכה של חלחול חקלאי לטרנספורמציה חולפת של צמחים עציים, תוך שימוש בצמחי קקאו כדוגמה. בהתחשב באילוץ הידוע שהקוטיקולה של העלים מייצגת לשינוי רקמות צמחים, התרכזנו בפיתוח אסטרטגיה שתקל על חלחול חקלאי על ידי ואקום בצמחים עציים, שהם בדרך כלל עקשנים להל?...
Disclosures
למחברים אין ניגוד עניינים להצהיר.
Acknowledgements
אנו מודים לליק. חסוס פואנטס גונסאלס ונסטור איבן רובלס אוליבארס על עזרתם בצילום קטעי הווידיאו. אנו מודים על תרומתה הנדיבה של ד"ר אנטוניה גוטיירז מורה מ- CIATEJ (צמחי קקאו תיאוברומה ). אנו מודים גם ל- CIATEJ ול- Laboratorio Nacional PlanTECC, מקסיקו, על התמיכה במתקנים. H.E.H.D. (CVU: 1135375) ערך מחקרי מאסטר במימון Consejo Nacional de Humanidades, Ciencia y Tecnología, México (CONAHCYT). R.U.L. מודה על תמיכתם של Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL), ו- Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, México (מענק 7270-2018).
Materials
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
References
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved