JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
난치성 식물의 식물 변형 을 위한 진공 강제 농업 여과: 사례 연구로서의 카카오
요약
여기에서는 대형 식물의 유전적 형질전환에 대한 생체 내 연구를 위한 국소 진공 침투를 위한 첫 번째 프로토콜을 제시합니다. 이 방법론을 사용하여 우리는 처음으로 카카오의 식물의 일시적인 변형에서 Agrobacterium을 매개 하는 것을 달성했습니다.
초록
식물 형질전환의 일시적 형질전환은 식물 유전자 형질전환을 위한 빠르고 비용 효율적인 대안입니다. planta 형질전환을 위한 대부분의 프로토콜은 Agrobacterium 매개 형질전환의 사용에 의존합니다. 그러나 현재 사용 중인 프로토콜은 대형 플랜트를 진공 처리에 투입해야 하는 물리적, 경제적 제약으로 인해 소규모 플랜트에 대해 표준화되어 있습니다. 이 연구는 대형 플랜트에 맞춤화된 국부적인 진공 기반 농업 침투를 위한 효과적인 프로토콜을 제시합니다. 제안된 방법의 효능을 평가하기 위해, 우리는 유전자 변형에 난치하는 열대 식물 종인 카카오 식물에서 그 사용을 테스트했습니다. 우리의 프로토콜은 카카오 잎의 국부적인 공중 부분에 최대 0.07MPa의 진공을 반복적으로 적용할 수 있도록 허용하여 부착된 잎의 세포 간 공간으로 아그로박테리움의 침투를 강제할 수 있도록 했습니다. 그 결과, 우리는 RUBY 리포터 시스템에 대해 발현되는 부착된 카카오 잎의 질경이 변형에서 Agrobacterium-mediated transient를 달성했습니다. 이것은 또한 카카오의 식물의 일시적인 변형에서 최초의 Agrobacterium 매개 사례입니다. 이 프로토콜은 유사한 크기 제약을 가진 다른 식물 종에 진공 기반 농업 침투 방법을 적용할 수 있도록 하고 난치성 목본, 대형 종의 유전자 식물 내 특성 분석을 위한 문을 열 것입니다.
서문
식물의 유전자 형질전환 방법은 유전자의 생물학적 기능을 검사하는 데 필수적이며, 포스트 게놈 시대(post-genomic era)에 예측된 많은 수의 특성화되지 않은 유전자를 고려할 때 오늘날 특히 유용하다1. 이러한 방법은 완전히 형질전환된 라인을 얻거나 유전자를 일시적으로 발현하는 데 사용할 수 있습니다. 안정된 형질전환은 숙주가 채택한 외래 DNA가 숙주 게놈에 완전하고 비가역적으로 통합되고 유전자 변형이 다음 세대로 전달될 때 발생합니다. 일시적 형질전환(transient transformation)으로 알려진 일시적 발현은 아그로박테리움(Agrobacterium )에 의해 숙주 게놈에 통합되지 않은 세포로 전달된 T-DNA의 여러 사본에서 발생하며, 감염 후 2-4일 후에 최고조에 달한다2.
일시적 발현 분석은 종종 유전자의 기능적 특성 분석에 충분하며 안정적인 형질전환에 비해 몇 가지 이점을 제공할 수 있다는 점은 주목할 가치가 있습니다. 예를 들어, 일시적 형질전환은 조직 배양 기반 재생 절차가 필요하지 않습니다. 또 다른 장점은 애기장대(Arabidopsis thaliana)3 및 니코티아나 벤타미아나(Nicotiana benthamiana)4와 같은 모델 식물 종에 대해 잘 표준화된 프로토콜의 몇 가지 성공적인 예가 존재하지만 여전히 비모델 종(5)에서는 제한적이라는 것입니다.
일시적 분석의 개발은 효율적인 유전자 전달 방법의 가용성에 달려 있습니다. 이를 위해 가장 인기 있는 접근법은 DNA를 식물 세포로 전달하는 아그로박테리움의 고유한 능력을 활용하는 아그로박테리움 침투를 기반으로 합니다6. 이러한 분석을 위한 또 다른 유용한 도구는 녹색 형광 단백질(GFP), β-글루쿠로니다아제(GUS), 루시페라아제 또는 RUBY와 같은 리포터 유전자를 사용하는 것이며, 이 모든 유전자는 형질전환 이벤트를 추적하는 데 사용됩니다. 이러한 리포터 시스템 중에서 RUBY는 현재 시각화하기 가장 쉬우며 세 가지 효소 단계 반응을 통해 티로신을 베타린으로 전환하는 데 의존합니다. 다른 리포터 시스템과는 달리, 생성된 베타린은 정교한 장비나 추가 반응물 없이도 형질전환된 식물 조직에서 밝은 색의 안료로 쉽게 관찰할 수 있다7.
아그로박테리움(Agrobacterium) 현탁액을 잎 중엽의 세포간 공간으로 침투시킬 때, 성공적인 농경감염을 위한 가장 중요한 단계는 잎의 표피 표피에 의해 부과되는 물리적 장벽을 극복하는 것이다8. 일부 식물의 경우, 니코티아나 벤타미아나(Nicotiana benthamiana)9에서 발생하는 것과 같이 바늘 없는 주사기(주사기 아그로인트레이션)로 생성된 압력 구배가 효율적인 아그로인트레이션을 위해 충분하지만, 다른 식물 종은 진공 펌프(10)의 도움으로 생성된 것과 같은 더 큰 압력 구배를 필요로 할 수 있다. 진공 보조 공정에서 농업 침투는 두 단계로 발생합니다. 첫 번째로, 진공은 식물 재료에 압력을 가하여 기공과 상처를 통해 중엽 공기 공간에서 가스를 방출하도록 하는 역할을 합니다. 그런 다음, 재가압 단계에서 아그로박테리움 현탁액은 기공을 통해 세포간 공간에 침투하여11에 상처를 입힌다.
주사기 침투에 비해 진공 침투는 더 높은 사용 빈도, 반복성 및 침투 공정의 모든 단계에서 압력 및 지속 시간을 제어할 수 있는 능력을 허용합니다10. 시금치(Spinacia oleracea)12, 작약(목본 다년생 식물)(Paeonia ostii)13 및 소콩(Vigna unguiculata)14과 같은 다양한 식물 종의 잎에서 진공 농업 침투 프로토콜은 주사기 침투보다 더 깊은 침투율을 달성했습니다. 유사하게, 토마토(Lycopersicon esculentum)15 및 거베라(Gerbera hybrida)16에서 진공 농업 침투는 주사기 침투보다 더 강력하고 균일한 유전자 침묵을 생성했습니다. 진공 침투의 또 다른 장점은 최근 세 가지 감귤류 품종(Fortunella obovata, Citrus limon 및 C. grandis)에서 관찰된 주사기 침투에 비해 유전자형에 대한 의존도가 낮다는 것입니다17. 그러나 데시케이터에 맞지 않을 정도로 큰 식물에 진공 농업 침투를 적용하려고 할 때 일반적으로 열대 목본 식물에서 발생하는 것처럼 진공 챔버의 크기가 제한될 수 있습니다.
아래에서는 진공 챔버의 공간적 한계를 극복하고 식물 내 카카오 잎의 일시적인 변형에 대한 유용성을 테스트하는 프로토콜에 대해 설명합니다. 카카오에 대한 최초의 국지적 진공 침투 방법을 제시하는데, 이 방법은 추가 장비가 필요하지 않고 전체 식물의 침투에 사용되는 것과 동일한 실험실 데시케이터를 사용할 수 있지만 진공 챔버 내부의 식물 일부에 접근할 수 있는 간단한 적응을 통해 식물 개발의 다양한 단계에서 사용할 수 있습니다. 제안된 국부적인 진공 침투 방법의 유용성을 테스트하기 위해 우리는 변형이 어려운 잎이 큰 열대 식물 종의 대용품으로 카카오를 선택했습니다. 이 국소 침윤 방법을 사용하여 우리는 최근에 이전에 분리된 잎에 대해 최적화된 조건에서 아그로박테리움 매개 진공 침투에 의한 아보카도의 식물 일시적 발현에서 첫 번째 사례를 보고했으며, 여기서는 카카오에서 첫 번째 질경이 일시적 발현을 보고했습니다.
프로토콜
1. Agrobacterium tumefaciens 문화
- Agrobacterium tumefaciens 균주 LBA4404의 전기 가능한 세포를 해동합니다.
- 효모 맥아(YM; 표 1) 육수를 17 mm x 100 mm 배양 튜브에 넣습니다. 나중을 위해 이 튜브를 보관하고 실온(RT)에 보관하십시오.
- 1.5mL 미세분리 튜브에 해동된 Agrobacterium 세포 30μL와 35S:RUBY를 포함하는 DNA 100-250ng(최대 5μL)를 추가합니다. 부드럽게 섞는다.
참고: 35S:RUBY 는 Yunde Zhao의 선물입니다. 샘플 아크를 방지하려면 이온 화합물의 존재를 최대한 줄이십시오. 이들 이온 화합물은 DNA(19)의 에탄올 침전으로부터 잔류 염일 수 있다. - 이 시점에서 얼음 위에 1mm 전기천공법 큐벳을 놓습니다.
- 이전 서스펜션 혼합물을 냉각된 1mm 전기천공법 큐벳으로 옮깁니다. 모든 것을 얼음 위에 두십시오. 큐벳의 금속 전극을 닦습니다.
- electroporator를 Agr (2.2kV, ~5ms, 1펄스)로 설정합니다. 큐벳을 electroporation 챔버 내부에 놓습니다.
- 펄스 버튼을 누릅니다. 펄스 파라미터를 등록합니다. 샘플이 아크를 그리면 전기 천공법 공정이 실패했습니다.
알림: 맥박 직후 세포를 YM 육수로 빠르게 옮기는 것이 중요합니다. 이 전송을 지연시키면 변환 효율이 크게 감소할 수 있습니다(20). - 즉시 저장된 YM 육수를 사용하여 큐벳에서 17mm x 100mm 튜브로 세포를 옮깁니다. 세포를 부드럽게 재현탁시킵니다.
- 형질전환된 세포를 궤도 인큐베이터에서 28°C 및 250rpm에서 3시간 동안 배양합니다.
참고: 이 배양물에는 항생제가 없습니다. 적절한 무균 조건에 주의하십시오. - 이 배양액을 선택적 YM 한천 플레이트에 줄무늬21. 형질전환된 LBA4404-RUBY 균주의 경우 이 플레이트에 리팜피신(25μg/mL), 스펙티노마이신(50μg/mL) 및 스트렙토마이신(50μg/mL)이 포함되어 있는지 확인합니다. 이 플레이트를 28°C 스탠딩 인큐베이터에서 밤새 배양합니다.
참고: 이 프로토콜에서는 spectinomycin(50μg/mL)에 대한 박테리아 내성을 부여하고 침윤된 식물 조직에 대한 시각적 리포터 역할을 하는 벡터 35S:RUBY 가 사용되었습니다. - 하룻밤 배양된 콜로니를 YM 육수와 Luria Bertani(LB) 육수(각각 9:1 비율)의 혼합물 12.5mL, MES 10mM, pH 5.722에 접종합니다. 이 선택적 액체 배지에 1.10단계에서 사용된 것과 동일한 항생제가 포함되어 있는지 확인하십시오. 표 1 을 참조하여 이러한 배지의 성분과 농도를 확인하십시오.
- 아그로박테리움(Agrobacterium)을 배양할 때, 배양을 위한 충분한 폭기 공간(액체 부피의 약 4-5배)을 남겨 두십시오. 세포 응집을 피하기 위해 Agrobacterium 균주 LBA4404에 YM 육수를 사용하십시오23.
- 28°C 궤도 인큐베이터에서 250rpm에서 16시간 동안 배양액을 배양합니다.
- 1.11단계에서 사용한 것과 동일한 배지를 사용하여 초기 부피의 최대 10배까지 배양을 확장합니다.
- 28°C 궤도 인큐베이터에서 16시간 및 250rpm으로 배양액을 배양합니다.
- 오버나이트 배양을 광학 밀도(OD600) 0.4로 조정합니다. 20μM의 아세토시링곤(AS)을 추가합니다.
- OD600 이 약 1.0에 도달할 때까지 28°C 궤도 인큐베이터에서 250rpm으로 배양합니다.
- 20°C에서 10분 동안 4,500 x g 에서 세포를 원심분리합니다.
- 펠릿을 현탁액(10mM MES, 10mM MgCl2, pH 5.7)으로 재현탁시키고 OD600 을 0.6으로 조정합니다. 200μM을24로 추가합니다.
알림: 현탁액을 28°C에서 사전 배양합니다. 첨가 시 현탁액이 차가우면 셀이 침전됩니다. - 박테리아 현탁액을 어두운 조건과 24°C에서 2-25시간 동안 그대로 두십시오. 교반이 필요하지 않습니다22.
2. 식물 선택
- agroinfiltration을위한 최적의 단계에서 잎이있는 가지가있는 식물을 선택하십시오.
알림: 식물은 다 자랐거나 성숙한 나무일 수 있습니다. 카카오는, C단의 새잎이 추천입니다. 이 잎은 청동색에서 밝은 녹색입니다. 그들은 완전히 확장되거나 단계 D 잎25만큼 단단하지 않습니다 (그림 1).- 대조군으로서, 사용된 균주 및 벡터에 대해 보고된 높은 농업 침투 효율을 가진 다른 식물(예: Nicotiana tabacum)에 대해 농업 침투를 동시에 수행합니다.
알림: 이 컨트롤에서 긍정적인 결과를 얻지 못한 경우 부정적인 결과는 사용된 변형 또는 벡터로 인한 것일 수 있습니다.
- 대조군으로서, 사용된 균주 및 벡터에 대해 보고된 높은 농업 침투 효율을 가진 다른 식물(예: Nicotiana tabacum)에 대해 농업 침투를 동시에 수행합니다.
3. 진공 챔버 설정
- 진공 챔버로 진공 게이지가 있는 데시케이터를 사용하여 내부의 진공 압력을 측정합니다.
- 250μM의 Jasmonic acid (JA)18,26을 1.19 단계의 Agrobacterium 현탁액에 첨가합니다.
- 아그로박테리움(Agrobacterium) 배양액을 입이 넓은 비커로 옮겨 선택한 가지와 잎을 담그십시오. 그런 다음 Agrobacterium 배양액이 있는 비커를 데시케이터 안에 넣습니다.
- 데시케이터와 뚜껑 사이에 가지를 놓습니다. 원하는 잎을 Agrobacterium 배양 안에 담그십시오. 다음으로, 식물 가지가 데시케이터에 들어갈 수 있도록 컷아웃이 있는 둥근 링인 점프 링을 사용합니다. 점프 링은 데시케이터의 하단과 상단 사이의 스페이서 역할도 합니다.
- 개스킷이 뚜껑으로 찌그러지지 않을 만큼 구조적으로 안정적인지, 데시케이터 둘레에 맞게 구부러지고 조정될 수 있을 만큼 유연한지, 다공성 재료로 만들어지지 않았는지 확인하십시오.
참고: 이 연구에서는 개스킷과 유사한 비다공성 플라스틱 재료로 코팅된 여러 개의 작은 와이어로 구성된 연선 금속 와이어를 사용했습니다(그림 2). - 나뭇가지를 데시케이터에 고정하려면 실리콘 인상재를 사용하십시오. 재료가 끈적거리고 다공성이 아니며 데시케이터와 식물에 화학적으로 불활성이며 가지, 개스킷 및 데시케이터 사이의 작은 틈을 쉽게 적용하고 채울 수 있는지 확인하십시오.
- 실리콘 인상재가 중합되고(약 1분 소요) 가지가 제자리에 고정되면 데시케이터를 닫습니다. 틈이 생기지 않도록 하십시오.
- 데시케이터를 진공 펌프에 연결합니다(그림 3).
4. 진공 침투
- -0.07MPa가 될 때까지 진공 펌프를 시작합니다.
- 이 압력에 도달하면 압력 밸브를 닫고 진공 펌프를 끕니다. 이 압력을 5분 동안 유지합니다.
- 압력 밸브를 열어 챔버 압력을 복원합니다.
참고: 이것은 중요한 단계입니다. 챔버 압력을 점진적으로 꾸준히 복원하십시오. 데시케이터를 완전히 재가압하는 데 최대 3분이 소요될 수 있습니다. 연장된 재가압은 조직(10) 내부에 침투하는 박테리아의 수를 증가시킨다. - 이 과정을 두 번 더 반복합니다.
- 셀 서스펜션과 데시케이터에서 가지를 제거합니다.
- 침투한 잎을 증류수로 청소하십시오.
5. 침투 된 잎의 부화
- 침투된 잎을 25°C의 어두운 조건에서 48시간 동안 그대로 두십시오.
- 그런 다음 침윤된 조직을 16/8시간의 밝은/어두운 광주기에 노출시킵니다.
- 감염 후 3-7일(DPI)의 일시적인 리프 변형을 평가합니다.

그림 1: 카카오는 발달 단계를 벗어납니다. (A-E) 발달 단계25. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
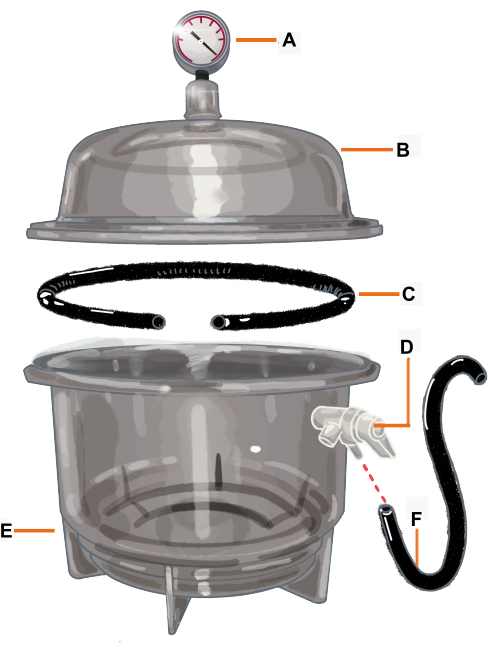
그림 2: 진공 챔버 구성 및 구성 요소. 진공 챔버는 진공 게이지에 연결된 데시케이터입니다. 개스킷/O-링이 절단되어 분기가 배치될 구멍이 있습니다. (A) 진공 게이지, (B) 뚜껑, (C) 개스킷/O-링, (D) 압력 밸브, (E) 데시케이터, (F) 호스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: planta 진공 농업 침투 시스템. 침투 과정에서 진공 손실을 방지하려면 브랜치를 데시케이터와 개스킷/O-링에 실리콘 인상재로 고정하는 것이 중요합니다. (A) 카카오 공장, (B) 진공 챔버, (C) 실리콘 인상재, (D) 아그로박테리움 현탁액에 잠긴 잎, (E) 진공 펌프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
이 프로토콜은 대형 목본 식물에 효과적인 농업 침투 방법을 제시합니다. 이 프로토콜을 통해 -0.07MPa의 진공 압력을 달성할 수 있었고, 그 결과 카카오 잎이 효과적이고 국부적으로 침투할 수 있었습니다. 그림 4에서는 침투 시스템 설정 프로세스를 관찰하고 그림 5에서는 최종 구성을 관찰합니다.
토론
이 연구에서 우리는 카카오 식물을 예로 들어 목본 식물의 일 시적 변형을 위한 효율적이고 저렴한 농업 침투 프로토콜을 제시했습니다. 잎의 큐티클이 식물 조직의 변형을 나타낸다는 잘 알려진 제약을 감안할 때, 우리는 일반적으로 이 절차에 거부적인 목본 식물에서 진공에 의한 농업 침투를 촉진하는 전략을 개발하는 데 집중했습니다.
진공 챔버 내부의 진공 압력?...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
Lic에게 감사드립니다. 헤수스 푸엔테스 곤잘레스(Jesús Fuentes González)와 네스토르 이반 로블레스 올리바레스(Néstor Iván Robles Olivares)는 비디오 촬영에 도움을 주었습니다. CIATEJ(테오브로마 카카오 식물)의 안토니아 구티에레스 모라(Antonia Gutierrez Mora) 박사의 관대한 기부에 감사드립니다. 또한 시설 지원에 대해 CIATEJ와 멕시코 Laboratorio Nacional PlanTECC에 감사드립니다. H.E.H.D. (CVU: 1135375)는 Consejo Nacional de Humanidades, Ciencia y Tecnología, México(CONAHCYT)의 자금 지원을 받아 마스터 스터디를 수행했습니다. RUL은 Consejo Estatal de Ciencia y Tecnología de Jalisco(COECYTJAL) 및 Secretaría de Innovación Ciencia y Tecnología(SICYT), Jalisco, México(Grant 7270-2018)의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
참고문헌
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유