É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Agroinfiltração Forçada a Vácuo para Transformação In planta de Plantas Recalcitrantes: Cacau como Estudo de Caso
Neste Artigo
Resumo
Aqui, apresentamos o primeiro protocolo de infiltração localizada a vácuo para estudos in vivo da transformação genética de plantas de grande porte. Utilizando esta metodologia, obteve-se pela primeira vez a transformação transitória do cacau mediada por Agrobacterium em planta.
Resumo
A transformação transitória em plantas é uma alternativa rápida e econômica para a transformação genética de plantas. A maioria dos protocolos para transformação in planta depende do uso de transformação mediada por Agrobacterium. No entanto, os protocolos atualmente em uso são padronizados para plantas de pequeno porte devido às restrições físicas e econômicas de submeter plantas de grande porte a um tratamento a vácuo. Este trabalho apresenta um protocolo eficaz para agroinfiltração localizada a vácuo customizada para plantas de grande porte. Para avaliar a eficácia do método proposto, testou-se seu uso em plantas de cacau, uma espécie de planta tropical recalcitrante à transformação genética. Nosso protocolo permitiu aplicar até 0,07 MPa de vácuo, com repetições, em uma parte aérea localizada das folhas de cacau, tornando possível forçar a infiltração de Agrobacterium nos espaços intercelulares das folhas aderidas. Como resultado, obteve-se a transformação transitória em planta mediada por Agrobacterium de folhas de cacau anexas expressando para o sistema repórter RUBI. Esta é também a primeira Agrobacterium-mediada em planta de transformação transitória do cacau. Este protocolo permitiria a aplicação do método de agroinfiltração a vácuo a outras espécies vegetais com restrições de tamanho semelhantes e abriria as portas para a caracterização in planta de genes em espécies lenhosas recalcitrantes de grande porte.
Introdução
Métodos de transformação genética vegetal são essenciais para testar as funções biológicas dos genes e são especialmente úteis nos dias de hoje, dado o grande número de genes não caracterizados previstos na era pós-genômica1. Estes métodos podem ser usados para obter linhas totalmente transformadas ou para expressar genes transitoriamente. A transformação estável ocorre quando o DNA estranho que o hospedeiro absorveu torna-se total e irreversivelmente integrado ao genoma do hospedeiro, e as modificações genéticas são transmitidas para as gerações seguintes. A expressão transitória, conhecida como transformação transitória, ocorre a partir de múltiplas cópias de T-DNA transferidas por Agrobacterium para dentro da célula, que não foram integradas ao genoma do hospedeiro, e atinge seu pico 2-4 dias após a infecção2.
Vale ressaltar que ensaios de expressão transitória são frequentemente suficientes para a caracterização funcional de genes e podem oferecer diversas vantagens sobre a transformação estável. Por exemplo, a transformação transitória não requer procedimentos de regeneração baseados em cultura de tecidos. Outra vantagem é que é compatível com a análise funcional de genes em planta , existindo vários exemplos bem sucedidos de protocolos bem padronizados para espécies de plantas-modelo, como Arabidopsis thaliana3 e Nicotiana benthamiana4, mas ainda limitado em espécies nãomodelo5.
O desenvolvimento de ensaios transientes depende da disponibilidade de métodos eficientes de transferência gênica. Para isso, as abordagens mais populares baseiam-se na infiltração da Agrobacterium , que aproveita a capacidade única da Agrobacterium de transferir DNA para as células vegetais6. Outra ferramenta útil para essas análises é o uso de genes repórteres, como proteínas fluorescentes verdes (GFP), β-glucuronidase (GUS), luciferase ou RUBY, todos empregados para rastrear eventos de transformação. Dentre esses sistemas repórteres, o RUBY é atualmente o mais fácil de visualizar e se baseia na conversão de tirosina em betalaínas através de três reações enzimáticas de passo. Ao contrário de outros sistemas repórteres, as betalaínas resultantes podem ser prontamente observadas como pigmentos de cores vivas no tecido vegetal transformado, sem a necessidade de equipamentos sofisticados ou reagentes adicionais7.
Ao infiltrar uma suspensão de Agrobacterium no espaço intercelular do mesofilo foliar, o passo mais crítico para o sucesso da agroinfecção é a superação da barreira física imposta pela cutícula epidérmica das folhas8. Enquanto para algumas plantas um gradiente de pressão criado com uma seringa sem agulha (seringa Agroinfiltration) é suficiente para uma agroinfiltração eficiente, como ocorre em Nicotiana benthamiana9, outras espécies vegetais podem requerer um gradiente de pressão maior, como o criado com o auxílio de bombas de vácuo10. Nos processos assistidos a vácuo, a agroinfiltração ocorre em duas etapas. Na primeira, o vácuo serve para submeter o material vegetal a pressão reduzida, forçando a liberação de gases dos espaços aéreos do mesofilo através de estômatos e feridas. Em seguida, durante uma fase de repressurização, a suspensão de Agrobacterium infiltra os espaços intercelulares através dos estômatos e fere11.
Em comparação com a infiltração da seringa, a infiltração a vácuo permite maior frequência de uso, repetibilidade e a capacidade de controlar a pressão e a duração em cada estágio do processo de infiltração10. Em folhas de diferentes espécies vegetais, como espinafre (Spinacia oleracea)12, peônia (perene lenhosa) (Paeonia ostii)13 e feijão-caupi (Vigna unguiculata)14, os protocolos de agroinfiltração a vácuo alcançaram uma taxa de infiltração mais profunda do que a infiltração da seringa. Da mesma forma, em tomateiro (Lycopersicon esculentum)15 e gérbera (Gerbera hybrida)16, a agroinfiltração a vácuo produziu silenciamento gênico mais forte e uniforme do que a infiltração em seringas. Uma vantagem adicional da infiltração a vácuo é a menor dependência do genótipo, comparada à infiltração de seringas, observada recentemente em três variedades de citros (Fortunella obovata, Citrus limon e C. grandis)17. No entanto, ao tentar aplicar agroinfiltração a vácuo em plantas que são muito grandes para caber em dessecadores, o tamanho das câmaras de vácuo pode ser uma limitação, como normalmente ocorre com plantas lenhosas tropicais.
A seguir, descrevemos um protocolo que supera a limitação espacial das câmaras de vácuo, testando sua utilidade para a transformação transitória in planta de folhas de cacau. Apresentamos o primeiro método de infiltração a vácuo localizada para cacau, que não requer equipamentos adicionais e ainda permite o uso dos mesmos dessecadores de laboratório utilizados para a infiltração de toda a planta, mas com uma adaptação simples que permite o acesso de uma parte da planta dentro da câmara de vácuo, permitindo sua utilização em diferentes estágios de desenvolvimento da planta. Para testar a utilidade do método de infiltração localizada a vácuo proposto, selecionamos o cacau como proxy de uma espécie de planta tropical de folhas grandes e difícil de transformar. Usando este método de infiltração localizada, recentemente relatamos a primeira expressão transitória em planta em abacate por infiltração a vácuo mediada por Agrobacterium com condições previamente otimizadas para folhas destacadas18, e aqui relatamos a primeira expressão transitória em planta em cacau.
Protocolo
1. Cultura de Agrobacterium tumefaciens
- Descongelar células eletrocompetentes da cepa Agrobacterium tumefaciens LBA4404.
- Adicionar 1 mL de malte de levedura (YM; Tabela 1) caldo para um tubo de cultura de 17 mm x 100 mm. Guarde este tubo para mais tarde e mantenha-o à temperatura ambiente (RT).
- Em um tubo de microfuga de 1,5 mL, adicionar 30 μL das células de Agrobacterium descongeladas e 100-250 ng (até 5 μL) do DNA contendo 35S:RUBY. Misture delicadamente.
NOTA: O 35S:RUBY foi um presente de Yunde Zhao. Para evitar o arqueamento de amostras, reduza ao máximo a presença de compostos iônicos. Esses compostos iônicos podem ser sais residuais da precipitação etanólica do DNA19. - Neste ponto, coloque uma cubeta de eletroporação de 1 mm no gelo.
- Transfira a mistura de suspensão anterior para uma cubeta de eletroporação resfriada de 1 mm. Mantenha tudo no gelo. Limpe os eletrodos metálicos da cubeta.
- Ajuste o eletroporador para Agr (2,2 kV, ~5 ms, 1 pulso). Coloque a cubeta dentro da câmara de eletroporação.
- Pressione o botão Pulse . Registre os parâmetros de pulso. Se a amostra se abriu, o processo de eletroporação falhou.
NOTA: É fundamental transferir rapidamente as células para o caldo YM logo após o pulso. Atrasar essa transferência pode reduzir drasticamente a eficiência da transformação20. - Imediatamente, use o caldo YM salvo para transferir as células da cubeta para o tubo de 17 mm x 100 mm. Ressuspenda as células suavemente.
- Incubar as células transformadas durante 3 h a 28 °C e 250 rpm numa incubadora orbital.
NOTA: Esta cultura não contém antibióticos; Seja cauteloso sobre condições assépticas adequadas. - Fixar esta cultura em placas seletivas de ágar YM21. Para a cepa LBA4404-RUBI transformada, verifique se essas placas contêm rifampicina (25 μg/mL), espectinomicina (50 μg/mL) e estreptomicina (50 μg/mL). Incubar esta placa durante a noite numa incubadora permanente a 28 °C.
OBS: Neste protocolo, foi utilizado o vetor 35S:RUBI , que confere resistência bacteriana à espectinomicina (50 μg/mL) e funciona como repórter visual sobre o tecido vegetal infiltrado. - Inocular colônias da cultura noturna em 12,5 mL de uma mistura de caldo YM e caldo Luria Bertani (LB) (na proporção de 9:1, respectivamente), 10 mM de MES, pH 5,722. Certifique-se de que este meio líquido selectivo contém os mesmos antibióticos utilizados no passo 1.10. Consulte a Tabela 1 para ver os ingredientes e concentrações desses meios.
- Ao incubar Agrobacterium, deixe espaço de aeração suficiente para a cultura, cerca de 4 a 5 vezes o volume líquido. Use caldo YM para LBA4404 cepa de Agrobacterium para evitar aglomeração celular23.
- Incubar a cultura por 16 h a 250 rpm em uma incubadora orbital de 28 °C.
- Escalar a cultura até 10 vezes o volume inicial com o mesmo meio utilizado na etapa 1.11.
- Incubar a cultura por 16 h e 250 rpm em uma incubadora orbital de 28 °C.
- Ajustar a cultura noturna para uma densidade óptica (OD600) de 0,4. Adicionar 20 μM de acetoseringona (AS).
- Incubar a 250 rpm em uma incubadora orbital de 28 °C até que OD600 atinja cerca de 1,0.
- Centrifugar as células a 4 500 x g durante 10 min a 20 °C.
- Ressuspender o pellet com solução de suspensão (10 mM MES, 10 mM MgCl2, pH 5,7), ajustando OD600 para 0,6. Adicionar 200 μM AS24.
NOTA: Pré-incubar a solução de suspensão a 28 °C. Se a solução de suspensão estiver fria quando adicionada, as células precipitar-se-ão. - Deixar a suspensão bacteriana durante 2-24 h em condições escuras e a 25 °C. Não é necessária agitação22.
2. Seleção de plantas
- Escolha uma planta com um galho com folhas no estágio ideal para a agroinfiltração.
NOTA: A planta pode ser adulta ou uma árvore madura. Para o cacau, recomendam-se folhas jovens de estágio C. Estas folhas são de bronze a verde claro; não são totalmente expandidos nem tão rígidos quanto as folhas do estágio D25 (Figura 1).- Como controle, realizar simultaneamente a agroinfiltração em outras plantas (por exemplo, Nicotiana tabacum) com uma alta eficiência de agroinfiltração que é relatada para a linhagem e vetor usados.
NOTA: Se nenhum resultado positivo for obtido neste controle, é possível que os resultados negativos sejam devidos à cepa ou ao vetor usado.
- Como controle, realizar simultaneamente a agroinfiltração em outras plantas (por exemplo, Nicotiana tabacum) com uma alta eficiência de agroinfiltração que é relatada para a linhagem e vetor usados.
3. Configuração da câmara de vácuo
- Como uma câmara de vácuo, use um exsicador que tenha um medidor de vácuo para medir a pressão de vácuo em seu interior.
- Adicionar 250 μM de ácido jasmônico (JA)18,26 à suspensão de Agrobacterium a partir do passo 1.19.
- Transfira a cultura de Agrobacterium para um copo de boca larga para submergir o ramo e as folhas selecionados. Em seguida, coloque o copo com cultura Agrobacterium dentro do dessecador.
- Coloque o galho entre o exsicador e sua tampa. Certifique-se de submergir as folhas desejadas dentro da cultura Agrobacterium . Em seguida, use um anel de salto, que é um anel redondo com um recorte que permite que o ramo da planta entre no dessecador. O Jump Ring também atua como um espaçador entre a parte inferior e superior do Dessecador.
- Certifique-se de que a junta é estruturalmente estável o suficiente para evitar ser esmagada com a tampa, flexível o suficiente para dobrar e ajustar à circunferência do dessecador, e não feita de um material poroso.
OBS: Este estudo utilizou um fio metálico encordoado constituído por vários fios menores torcidos entre si, revestidos com um material plástico não poroso semelhante a uma junta (Figura 2). - Para fixar o ramo no dessecador, use material de moldagem de silicone. Certifique-se de que o material é pegajoso, não poroso, quimicamente inerte ao exsicador e à planta, e fácil de aplicar e preencher pequenas lacunas entre o ramo, a junta e o dessecador.
- Uma vez que o material de impressão de silicone polimeriza (isso leva cerca de 1 min) e fixa o ramo no lugar, feche o dessecador. Certifique-se de não deixar lacunas.
- Conecte o exsicador à bomba de vácuo (Figura 3).
4. Infiltração a vácuo
- Ligue a bomba de vácuo até atingir -0,07 MPa.
- Quando atingir essa pressão, feche a válvula de pressão e desligue a bomba de vácuo. Mantenha essa pressão por 5 min.
- Abra a válvula de pressão para restaurar a pressão da câmara.
Observação : esta é uma etapa crítica. Restaure a pressão da câmara de forma gradual e constante. Pode levar até 3 minutos para repressurizar totalmente o dessecador. A repressurização prolongada aumenta o número de bactérias infiltradas no interior do tecido10. - Repita esse processo mais duas vezes.
- Retire o ramo da suspensão celular e do dessecador.
- Limpe as folhas infiltradas com água destilada.
5. Incubação das folhas infiltradas
- Deixe as folhas infiltradas permanecerem no escuro a 25 °C por 48 h.
- Em seguida, expor o tecido infiltrado a um fotoperíodo claro/escuro de 16/8 horas.
- Avaliar a transformação foliar transitória 3-7 dias pós-infecção (IPS).

Figura 1: Fases de desenvolvimento das folhas do cacau. (A-E) Estágios de desenvolvimento25. Clique aqui para ver uma versão maior desta figura.
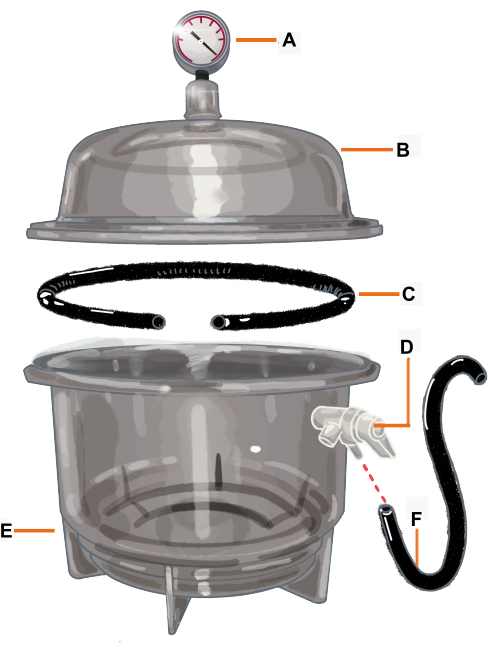
Figura 2: Configuração da câmara de vácuo e seus componentes. A câmara de vácuo é um exsicador conectado a um medidor de vácuo. A junta / O-ring é cortada para que tenha uma abertura onde o ramo será colocado. (A) Medidor de vácuo, (B) Tampa, (C) Junta/O-ring, (D) Válvula de pressão, (E) Dessecador, (F) Mangueira. Clique aqui para ver uma versão maior desta figura.

Figura 3: Sistema de agroinfiltração a vácuo in planta . Para evitar perdas de vácuo durante o processo de infiltração, é fundamental fixar o ramo ao exsicador e à junta/O-ring com material de moldagem de silicone. (A) Cacau, (B) Câmara de vácuo, (C) Material de impressão de silicone, (D) Folhas submersas em suspensão de Agrobacterium , (E) Bomba de vácuo. Clique aqui para ver uma versão maior desta figura.
Resultados
Este protocolo apresenta um método eficaz de agroinfiltração para plantas lenhosas de grande porte. Com este protocolo, conseguimos atingir uma pressão de vácuo de -0,07 MPa, resultando na infiltração efetiva e localizada das folhas do cacau. Na Figura 4, observa-se o processo de montagem do sistema de infiltração e, na Figura 5, a configuração final.
Discussão
Neste trabalho, apresentamos um protocolo de agroinfiltração eficiente e de baixo custo para a transformação transitória in planta de plantas lenhosas, usando como exemplo plantas de cacau. Dada a conhecida restrição que a cutícula das folhas representa para a transformação dos tecidos vegetais, concentramo-nos no desenvolvimento de uma estratégia para facilitar a agroinfiltração por vácuo em plantas lenhosas, que geralmente são recalcitrantes a esse procedimento.
A pre...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos a Lic. Jesús Fuentes González e Néstor Iván Robles Olivares pela ajuda na filmagem do vídeo. Agradecemos os generosos presentes da Dra. Antonia Gutierrez Mora do CIATEJ (Theobroma cacao plants). Agradecemos também ao CIATEJ e ao Laboratorio Nacional PlanTECC, México, pelo apoio às instalações. H.E.H.D. (CVU: 1135375) realizou estudos de mestrado com financiamento do Consejo Nacional de Humanidades, Ciencia y Tecnología, México (CONAHCYT). A R.U.L. agradece o apoio do Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) e da Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, México (Grant 7270-2018).
Materiais
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Referências
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados