Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Agro-infiltration forcée sous vide pour la transformation in planta de plantes récalcitrantes : le cacao comme étude de cas
Dans cet article
Résumé
Nous présentons ici le premier protocole d’infiltration sous vide localisée pour des études in vivo de la transformation génétique de plantes de grande taille. En utilisant cette méthodologie, nous avons réalisé pour la première fois la transformation transitoire du cacao par Agrobacterium in planta .
Résumé
La transformation transitoire in planta est une alternative rapide et rentable pour la transformation génétique végétale. La plupart des protocoles de transformation in planta reposent sur l’utilisation de la transformation médiée par Agrobacterium. Cependant, les protocoles actuellement utilisés sont standardisés pour les usines de petite taille en raison des contraintes physiques et économiques liées à la soumission des usines de grande taille à un traitement sous vide. Ce travail présente un protocole efficace pour l’agroinfiltration localisée sous vide adaptée aux plantes de grande taille. Pour évaluer l’efficacité de la méthode proposée, nous avons testé son utilisation chez les cacaoyers, une espèce végétale tropicale récalcitrante à la transformation génétique. Notre protocole a permis d’appliquer jusqu’à 0,07 MPa sous vide, avec répétitions, sur une partie aérienne localisée des feuilles de cacaoyer, permettant de forcer l’infiltration d’Agrobacterium dans les espaces intercellulaires des feuilles attachées. En conséquence, nous avons réalisé la transformation transitoire médiée par Agrobacterium in planta des feuilles de cacao attachées exprimant pour le système rapporteur Ruby. Il s’agit également de la première transformation transitoire du cacao par Agrobacterium in planta . Ce protocole permettrait l’application de la méthode d’agroinfiltration sous vide à d’autres espèces végétales ayant des contraintes de taille similaires et ouvrirait la porte à la caractérisation in planta des gènes chez des espèces ligneuses récalcitrantes de grande taille.
Introduction
Les méthodes de transformation génétique végétale sont essentielles pour tester les fonctions biologiques des gènes et sont particulièrement utiles aujourd’hui compte tenu du grand nombre de gènes non caractérisés prédits dans l’ère post-génomique1. Ces méthodes peuvent être utilisées pour obtenir des lignées entièrement transformées ou pour exprimer des gènes de manière transitoire. La transformation stable se produit lorsque l’ADN étranger que l’hôte a absorbé s’intègre complètement et irréversiblement dans le génome de l’hôte, et que les modifications génétiques sont transmises aux générations suivantes. L’expression transitoire, connue sous le nom de transformation transitoire, se produit à partir des multiples copies d’ADN-T transférées par Agrobacterium dans la cellule, qui n’ont pas été intégrées dans le génome de l’hôte, et atteint son apogée 2 à 4 jours après l’infection2.
Il convient de noter que les tests d’expression transitoire sont souvent suffisants pour la caractérisation fonctionnelle des gènes et peuvent offrir plusieurs avantages par rapport à la transformation stable. Par exemple, la transformation transitoire ne nécessite pas de procédures de régénération basées sur la culture tissulaire. Un autre avantage est qu’il est compatible avec l’analyse fonctionnelle in planta des gènes, existant plusieurs exemples réussis de protocoles bien standardisés pour des espèces végétales modèles, telles que Arabidopsis thaliana3 et Nicotiana benthamiana4, mais encore limité chez les espèces non modèles5.
Le développement de tests transitoires repose sur la disponibilité de méthodes efficaces de transfert de gènes. Pour cela, les approches les plus populaires sont basées sur l’infiltration d’Agrobacterium , qui tire parti de la capacité unique d’Agrobacterium à transférer l’ADN aux cellules végétales 6. Un autre outil utile pour ces analyses est l’utilisation de gènes rapporteurs, tels que les protéines fluorescentes vertes (GFP), la β-glucuronidase (GUS), la luciférase ou RUBY, qui sont tous utilisés pour suivre les événements de transformation. Parmi ces systèmes rapporteurs, RUBY est actuellement le plus facile à visualiser et repose sur la conversion de la tyrosine en bétalaïnes par trois réactions enzymatiques. Contrairement à d’autres systèmes rapporteurs, les bétalaïnes résultantes peuvent être facilement observées sous forme de pigments de couleurs vives sur des tissus végétaux transformés sans avoir besoin d’équipement sophistiqué ou de réactifs supplémentaires7.
Lors de l’infiltration d’une suspension d’Agrobacterium dans l’espace intercellulaire du mésophylle des feuilles, l’étape la plus critique pour une agro-infection réussie consiste à surmonter la barrière physique imposée par la cuticule épidermique des feuilles8. Alors que pour certaines plantes, un gradient de pression créé avec une seringue sans aiguille (seringue Agroinfiltration) est suffisant pour une agro-infiltration efficace, comme c’est le cas chez Nicotiana benthamiana9, d’autres espèces végétales peuvent nécessiter un gradient de pression plus important comme celui créé à l’aide de pompes à vide10. Dans les procédés assistés par le vide, l’agro-infiltration se fait en deux étapes. Dans le premier, le vide sert à soumettre la matière végétale à une pression réduite, forçant la libération de gaz des espaces aériens du mésophylle à travers les stomates et les plaies. Puis, lors d’une phase de repressurisation, la suspension d’Agrobacterium s’infiltre dans les espaces intercellulaires via les stomates et blesse11.
Par rapport à l’infiltration par seringue, l’infiltration sous vide permet une fréquence d’utilisation plus élevée, une répétabilité et la possibilité de contrôler la pression et la durée à chaque étape du processus d’infiltration10. Dans les feuilles de différentes espèces végétales telles que l’épinard (Spinacia oleracea)12, la pivoine (une plante vivace ligneuse) (Paeonia ostii)13 et le niébé (Vigna unguiculata)14, les protocoles d’agroinfiltration sous vide ont permis d’obtenir un taux d’infiltration plus profond que l’infiltration à la seringue. De même, chez la tomate (Lycopersicon esculentum)15 et le gerbera (Gerbera hybrida)16, l’agro-infiltration sous vide a produit un silençage génique plus fort et plus uniforme que l’infiltration à la seringue. Un autre avantage de l’infiltration sous vide est la moindre dépendance au génotype, par rapport à l’infiltration à la seringue, qui a été observée récemment chez trois variétés d’agrumes (Fortunella obovata, Citrus limon et C. grandis)17. Cependant, lorsque vous essayez d’appliquer l’agro-infiltration sous vide à des plantes trop grandes pour tenir dans des dessiccateurs, la taille des chambres à vide peut être une limitation, comme c’est généralement le cas avec les plantes ligneuses tropicales.
Ci-dessous, nous décrivons un protocole qui surmonte la limitation spatiale des chambres à vide, en testant son utilité pour la transformation transitoire in planta des feuilles de cacao. Nous présentons la première méthode d’infiltration sous vide localisée pour le cacao, qui ne nécessite pas d’équipement supplémentaire et permet même l’utilisation des mêmes dessiccateurs de laboratoire que ceux utilisés pour l’infiltration de l’ensemble de la plante, mais avec une adaptation simple qui permet l’accès d’une partie de la plante à l’intérieur de la chambre à vide, permettant son utilisation à différents stades du développement de la plante. Pour tester l’utilité de la méthode d’infiltration sous vide localisée proposée, nous avons sélectionné le cacao comme proxy d’une espèce végétale tropicale à grandes feuilles difficile à transformer. En utilisant cette méthode d’infiltration localisée, nous avons récemment rapporté la première expression transitoire in planta chez l’avocat par infiltration sous vide médiée par Agrobacterium avec des conditions précédemment optimisées pour les feuilles détachées18, et ici nous rapportons la première expression transitoire in planta dans le cacao.
Protocole
1. Culture d’Agrobacterium tumefaciens
- Décongeler les cellules électrocompétentes de la souche LBA4404 d’Agrobacterium tumefaciens .
- Ajouter 1 mL de malt de levure (YM ; Tableau 1) dans un tube de culture de 17 mm x 100 mm. Conservez ce tube pour plus tard et conservez-le à température ambiante (RT).
- Dans un tube de microfuge de 1,5 mL, ajouter 30 μL de cellules Agrobacterium décongelées et 100-250 ng (jusqu’à 5 μL) d’ADN contenant 35S :RUBY. Mélangez doucement.
NOTE : Le 35S :RUBY était un cadeau de Yunde Zhao. Pour éviter la formation d’arcs électriques, réduisez autant que possible la présence de composés ioniques. Ces composés ioniques peuvent être des sels résiduels de la précipitation de l’éthanol de l’ADN19. - À ce stade, placez une cuvette d’électroporation de 1 mm sur de la glace.
- Transférer le mélange de suspension précédent dans une cuvette d’électroporation réfrigérée de 1 mm. Gardez tout sur la glace. Essuyez les électrodes métalliques de la cuvette.
- Réglez l’électroporateur sur Agr (2,2 kV, ~5 ms, 1 impulsion). Placez la cuvette à l’intérieur de la chambre d’électroporation.
- Appuyez sur le bouton Pulse . Enregistrez les paramètres d’impulsion. Si l’échantillon produisait un arc électrique, le processus d’électroporation échouait.
REMARQUE : Il est essentiel de transférer rapidement les cellules dans le bouillon YM juste après l’impulsion. Retarder ce transfert peut réduire considérablement l’efficacité de la transformation20. - Utilisez immédiatement le bouillon YM enregistré pour transférer les cellules de la cuvette vers le tube de 17 mm x 100 mm. Remettez les cellules en suspension doucement.
- Incuber les cellules transformées pendant 3 h à 28 °C et 250 tr/min sur un incubateur orbital.
REMARQUE : Cette culture ne contient pas d’antibiotiques ; Soyez prudent quant aux conditions d’asepsie appropriées. - Étaler cette culture sur des plaques sélectives de gélose YM21. Pour la souche LBA4404-RUBY transformée, assurez-vous que ces plaques contiennent de la rifampicine (25 μg/mL), de la spectinomycine (50 μg/mL) et de la streptomycine (50 μg/mL). Incuber cette plaque pendant une nuit dans un incubateur sur pied à 28 °C.
REMARQUE : Dans ce protocole, le vecteur 35S :RUBY a été utilisé, qui confère une résistance bactérienne à la spectinomycine (50 μg/mL) et fonctionne comme un rapporteur visuel sur les tissus végétaux infiltrés. - Inoculer les colonies de la culture de nuit sur 12,5 mL d’un mélange de bouillon YM et de bouillon Luria Bertani (LB) (dans une proportion de 9:1, respectivement), 10 mM de MES, pH 5,722. Assurez-vous que ce milieu liquide sélectif contient les mêmes antibiotiques que ceux utilisés à l’étape 1.10. Reportez-vous au tableau 1 pour voir les ingrédients et les concentrations de ces milieux.
- Lors de l’incubation d’Agrobacterium, laissez suffisamment d’espace d’aération pour la culture, environ 4 à 5 fois le volume de liquide. Utilisez le bouillon YM pour la souche LBA4404 d’Agrobacterium pour éviter l’agglutination des cellules23.
- Incuber la culture pendant 16 h à 250 tr/min sur un incubateur orbital à 28 °C.
- Mettez la culture à l’échelle jusqu’à 10 fois le volume initial avec le même milieu que celui utilisé à l’étape 1.11.
- Incuber la culture pendant 16 h et 250 tr/min sur un incubateur orbital à 28 °C.
- Ajuster la culture de nuit à une densité optique (OD600) de 0,4. Ajouter 20 μM d’acétosyringone (AS).
- Incuber à 250 tr/min sur un incubateur orbital à 28 °C jusqu’à ce que OD600 atteigne environ 1,0.
- Centrifuger les cellules à 4 500 x g pendant 10 min à 20 °C.
- Remettre la pastille en suspension avec une solution en suspension (10 mM MES, 10 mM MgCl2, pH 5,7), en ajustant OD600 à 0,6. Ajouter 200 μM AS24.
REMARQUE : Pré-incuber la solution de suspension à 28 °C. Si la solution de suspension est froide lorsqu’elle est ajoutée, les cellules précipiteront. - Laisser la suspension bactérienne pendant 2 à 24 h dans des conditions sombres et à 25 °C. L’agitation n’est pas nécessaire22.
2. Sélection des plantes
- Choisissez une plante avec une branche avec des feuilles au stade optimal pour l’agroinfiltration.
REMARQUE : La plante peut être adulte ou mature. Pour le cacao, les jeunes feuilles du stade C sont recommandées. Ces feuilles sont de couleur bronze à vert clair ; elles ne sont pas complètement expansées ni aussi rigides que les feuilles de stade D25 (figure 1).- Comme témoin, effectuer simultanément une agro-infiltration sur d’autres plantes (par exemple, Nicotiana tabacum) avec une efficacité d’agroinfiltration élevée qui est rapportée pour la souche et le vecteur utilisés.
REMARQUE : Si aucun résultat positif n’est obtenu dans ce contrôle, il est possible que les résultats négatifs soient dus à la déformation ou au vecteur utilisé.
- Comme témoin, effectuer simultanément une agro-infiltration sur d’autres plantes (par exemple, Nicotiana tabacum) avec une efficacité d’agroinfiltration élevée qui est rapportée pour la souche et le vecteur utilisés.
3. Configuration de la chambre à vide
- En tant que chambre à vide, utilisez un dessiccateur doté d’un vacuomètre pour mesurer la pression du vide à l’intérieur.
- Ajouter 250 μM d’acide jasmonique (JA)18,26 à la suspension d’Agrobacterium à partir de l’étape 1.19.
- Transférez la culture d’Agrobacterium dans un bécher à large ouverture pour immerger la branche et les feuilles sélectionnées. Ensuite, placez le bécher avec la culture Agrobacterium à l’intérieur du dessiccateur.
- Placez la branche entre le dessiccateur et son couvercle. Assurez-vous d’immerger les feuilles souhaitées à l’intérieur de la culture Agrobacterium . Ensuite, utilisez un anneau de jonction, qui est un anneau rond avec une découpe qui permet à la branche de la plante d’entrer dans le dessiccateur. L’anneau de jonction agit également comme une entretoise entre le bas et le haut du dessiccateur.
- Assurez-vous que le joint est structurellement suffisamment stable pour éviter d’être écrasé avec le couvercle, suffisamment flexible pour se plier et s’ajuster à la circonférence du dessiccateur, et non fait d’un matériau poreux.
NOTE : Cette étude a utilisé un fil métallique toronné composé de plusieurs fils plus petits torsadés ensemble, recouverts d’un matériau plastique non poreux ressemblant à un joint d’étanchéité (figure 2). - Pour fixer la branche sur le dessiccateur, utilisez un matériau d’empreinte en silicone. Assurez-vous que le matériau est collant, non poreux, chimiquement inerte pour le dessiccateur et la plante, et facile à appliquer et remplissez les petits espaces entre la branche, le joint et le dessiccateur.
- Une fois que le matériau d’empreinte en silicone polymérise (cela prend environ 1 min) et fixe la branche en place, fermez le dessiccateur. Assurez-vous de ne pas laisser d’espaces.
- Connectez le dessiccateur à la pompe à vide (Figure 3).
4. Infiltration sous vide
- Démarrez la pompe à vide jusqu’à ce qu’elle atteigne -0,07 MPa.
- Une fois cette pression atteinte, fermez la soupape de pression et éteignez la pompe à vide. Maintenez cette pression pendant 5 min.
- Ouvrez la soupape de pression pour rétablir la pression de la chambre.
REMARQUE : Il s’agit d’une étape critique. Rétablissez la pression de la chambre progressivement et régulièrement. La repressurisation complète du dessiccateur peut prendre jusqu’à 3 minutes. Une repressurisation prolongée augmente le nombre de bactéries infiltrées à l’intérieur du tissu10. - Répétez ce processus deux fois de plus.
- Retirez la branche de la suspension cellulaire et du dessiccateur.
- Nettoyez les feuilles infiltrées avec de l’eau distillée.
5. Incubation des feuilles infiltrées
- Laissez les feuilles infiltrées rester dans l’obscurité à 25 °C pendant 48 h.
- Ensuite, exposez le tissu infiltré à une photopériode lumière/obscurité de 16/8 h.
- Évaluer la transformation transitoire des feuilles 3 à 7 jours après l’infection (DPI).

Figure 1 : Le cacao quitte les stades de développement. (A-E) Stades de développement25. Veuillez cliquer ici pour voir une version agrandie de cette figure.
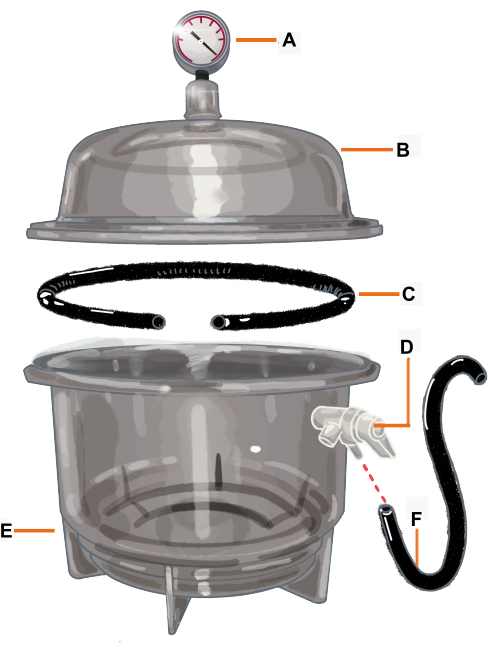
Figure 2 : Configuration de la chambre à vide et de ses composants. La chambre à vide est un dessiccateur relié à un vacuomètre. Le joint / joint torique est coupé de manière à avoir une ouverture où la branche sera placée. (A) Manomètre à vide, (B) Couvercle, (C) Joint / joint torique, (D) Soupape de pression, (E) Dessiccateur, (F) Tuyau. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Système d’agroinfiltration sous vide in planta. Pour éviter les pertes de vide pendant le processus d’infiltration, il est essentiel de fixer la branche au dessiccateur et au joint/joint torique avec un matériau d’empreinte en silicone. (A) Plante de cacao, (B) Chambre à vide, (C) Matériau d’empreinte en silicone, (D) Feuilles immergées sur une suspension d’Agrobacterium, (E) Pompe à vide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Ce protocole présente une méthode d’agroinfiltration efficace pour les plantes ligneuses de grande taille. Avec ce protocole, nous avons pu atteindre une pression de vide de -0,07 MPa, ce qui a permis une infiltration efficace et localisée des feuilles de cacaoyer. Sur la figure 4, nous observons le processus de mise en place du système d’infiltration, et sur la figure 5, la configuration finale.
Discussion
Dans ce travail, nous avons présenté un protocole d’agroinfiltration efficace et peu coûteux pour la transformation transitoire in planta des plantes ligneuses, en utilisant les plants de cacao comme exemple. Compte tenu de la contrainte bien connue que représente la cuticule des feuilles pour la transformation des tissus végétaux, nous nous sommes concentrés sur le développement d’une stratégie pour faciliter l’agroinfiltration par vide chez les plantes ligneuses, habituellement récalcitrantes ?...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions Lic. Jesús Fuentes González et Néstor Iván Robles Olivares pour leur aide dans le tournage de la séquence vidéo. Nous remercions le Dr Antonia Gutierrez Mora de CIATEJ (plantes de cacao Theobroma ) pour ses généreux dons. Nous remercions également CIATEJ et Laboratorio Nacional PlanTECC, Mexique, pour leur soutien à l’installation. S.E.H.D. (CVU : 1135375) a mené des études de master avec le financement du Consejo Nacional de Humanidades, Ciencia y Tecnología, Mexique (CONAHCYT). R.U.L. remercie le Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) et le Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, Mexique (subvention 7270-2018).
matériels
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Références
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon