Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnatçı Bitkilerin Planta Dönüşümü için Vakumla Zorla Agroinfiltrasyon: Bir Vaka Çalışması Olarak Kakao
Bu Makalede
Özet
Burada, büyük boyutlu bitkilerin genetik dönüşümünün in vivo çalışmaları için lokalize vakum infiltrasyonu için ilk protokolü sunuyoruz. Bu metodolojiyi kullanarak, ilk kez kakaonun planta geçici dönüşümünde Agrobacterium aracılı hale getirdik.
Özet
Planta transformasyonunda geçici, bitki genetik transformasyonu için hızlı ve uygun maliyetli bir alternatiftir. Planta dönüşümü için çoğu protokol, Agrobacterium aracılı dönüşümün kullanımına dayanır. Bununla birlikte, şu anda kullanımda olan protokoller, büyük boyutlu bitkilerin vakum işlemine tabi tutulmasının fiziksel ve ekonomik kısıtlamaları nedeniyle küçük boyutlu tesisler için standartlaştırılmıştır. Bu çalışma, büyük boyutlu bitkiler için özelleştirilmiş lokalize vakum tabanlı agroinfiltrasyon için etkili bir protokol sunmaktadır. Önerilen yöntemin etkinliğini değerlendirmek için, genetik dönüşüme karşı inatçı tropikal bir bitki türü olan kakao bitkilerinde kullanımını test ettik. Protokolümüz, kakao yapraklarının lokalize bir hava kısmına tekrarlarla 0.07 MPa'ya kadar vakum uygulanmasına izin vererek, Agrobacterium'un bağlı yaprakların hücreler arası boşluklarına sızmasını mümkün kıldı. Sonuç olarak, RUBY raportör sistemi için eksprese edilen ekli kakao yapraklarının planta dönüşümünde Agrobacterium aracılı geçici elde ettik. Bu aynı zamanda kakaonun planta geçici dönüşümünde aracılık edilen ilk Agrobacterium'dur. Bu protokol, vakum bazlı agroinfiltrasyon yönteminin benzer boyut kısıtlamalarına sahip diğer bitki türlerine uygulanmasına izin verecek ve inatçı odunsu, büyük boyutlu türlerde genlerin bitki karakterizasyonu için kapıyı açacaktır.
Giriş
Bitki genetik dönüşüm yöntemleri, genlerin biyolojik işlevlerini test etmek için gereklidir ve genom sonrası dönemde tahmin edilen çok sayıda karakterize edilmemiş gen göz önüne alındığında günümüzde özellikle yararlıdır1. Bu yöntemler, tamamen dönüştürülmüş çizgiler elde etmek veya genleri geçici olarak ifade etmek için kullanılabilir. Kararlı dönüşüm, konakçının aldığı yabancı DNA, konakçı genomuna tamamen ve geri döndürülemez bir şekilde entegre olduğunda ve genetik modifikasyonlar sonraki nesillere aktarıldığında meydana gelir. Geçici transformasyon olarak bilinen geçici ekspresyon, Agrobacterium tarafından hücreye aktarılan, konakçı genomuna entegre edilmemiş T-DNA'nın çoklu kopyalarından oluşur ve enfeksiyondan 2-4 gün sonra zirve yapar2.
Geçici ekspresyon tahlillerinin genellikle genlerin fonksiyonel karakterizasyonu için yeterli olduğunu ve kararlı dönüşüme göre çeşitli avantajlar sunabileceğini belirtmekte fayda var. Örneğin, geçici dönüşüm, doku kültürüne dayalı rejenerasyon prosedürleri gerektirmez. Diğer bir avantaj, Arabidopsis thaliana3 ve Nicotiana benthamiana4 gibi model bitki türleri için iyi standartlaştırılmış birkaç başarılı protokol örneği olan genlerin planta fonksiyonel analizi ile uyumlu olmasıdır, ancak model olmayan türlerdehala sınırlıdır 5.
Geçici tahlillerin geliştirilmesi, verimli gen transfer yöntemlerinin mevcudiyetine dayanır. Bunun için en popüler yaklaşımlar, Agrobacterium'un DNA'yı bitki hücrelerine aktarma konusundaki benzersiz yeteneğinden yararlanan Agrobacterium infiltrasyonuna dayanmaktadır6. Bu analizler için bir başka yararlı araç, tümü dönüşüm olaylarını izlemek için kullanılan yeşil floresan proteinleri (GFP), β-glukuronidaz (GUS), lusiferaz veya RBY gibi raportör genlerin kullanılmasıdır. Bu raportör sistemler arasında, RUBY şu anda görselleştirilmesi en kolay olanıdır ve üç enzimatik adım reaksiyonu yoluyla tirozinin betalainlere dönüştürülmesine dayanır. Diğer raporlayıcı sistemlerin aksine, ortaya çıkan betalainler, karmaşık ekipmana veya ek reaktanlara ihtiyaç duymadan dönüştürülmüş bitki dokusu üzerinde parlak renkli pigmentler olarak kolayca gözlemlenebilir7.
Bir Agrobacterium süspansiyonunu yaprak mezofilinin hücreler arası boşluğuna sızarken, başarılı agroenfeksiyon için en kritik adım, yapraklarınepidermal kütikülünün dayattığı fiziksel engelin üstesinden gelmektir 8. Bazı bitkiler için, iğnesiz bir şırınga (şırınga Agroinfiltrasyonu) ile oluşturulan bir basınç gradyanı, verimli bir agroinfiltrasyon için yeterli olsa da, Nicotiana benthamiana9'da olduğu gibi, diğer bitki türleri, vakum pompaları yardımıyla oluşturulan gibi daha büyük bir basınç gradyanı gerektirebilir10. Vakum destekli işlemlerde, agroinfiltrasyon iki adımda gerçekleşir. İlkinde vakum, bitki materyalini düşük basınca maruz bırakmaya hizmet eder ve gazların mezofil hava boşluklarından stomalar ve yaralar yoluyla salınmasını zorlar. Daha sonra, bir yeniden basınçlandırma aşaması sırasında, Agrobacterium süspansiyonu stomalar yoluyla hücreler arası boşluklara sızar veyaralar 11.
Şırınga sızması ile karşılaştırıldığında, vakum sızması, daha yüksek kullanım sıklığı, tekrarlanabilirlik ve sızma işleminin her aşamasında basıncı ve süreyi kontrol etme yeteneği sağlar10. Ispanak (Spinacia oleracea)12, şakayık (çok yıllık odunsu bir bitki) (Paeonia ostii)13 ve Börülce (Vigna unguiculata)14 gibi farklı bitki türlerinin yapraklarında, vakumlu agroinfiltrasyon protokolleri, şırınga infiltrasyonundan daha derin bir infiltrasyon oranı elde etti. Benzer şekilde, domateste (Lycopersicon esculentum)15 ve gerbera'da (Gerbera hybrida)16, vakumlu agroinfiltrasyon, şırınga infiltrasyonundan daha güçlü ve daha homojen gen susturma üretti. Vakum infiltrasyonunun ek bir avantajı, son zamanlarda üç narenciye çeşidinde (Fortunella obovata, Citrus limon ve C. grandis) gözlenen şırınga infiltrasyonuna kıyasla genotipe daha düşük bağımlılıktır17. Bununla birlikte, desikatörlere sığamayacak kadar büyük bitkilere vakumlu agroinfiltrasyon uygulamaya çalışırken, tipik olarak tropikal odunsu bitkilerde olduğu gibi, vakum odalarının boyutu bir sınırlama olabilir.
Aşağıda, vakum odalarının uzamsal sınırlamasının üstesinden gelen ve kakao yapraklarının planta geçici dönüşümü için faydasını test eden bir protokolü açıklıyoruz. Kakao için ek ekipman gerektirmeyen ve hatta tüm bitkinin sızması için kullanılan aynı laboratuvar kurutucularının kullanımına izin veren, ancak bitkinin bir kısmının vakum odası içinde erişmesine izin veren basit bir uyarlama ile ilk lokalize vakum infiltrasyon yöntemini sunuyoruz. Önerilen lokalize vakum sızma yönteminin kullanışlılığını test etmek için, kakaoyu dönüştürülmesi zor olan büyük yapraklı tropikal bir bitki türünün vekili olarak seçtik. Bu lokalize infiltrasyon yöntemini kullanarak, yakın zamanda avokadoda Agrobacterium aracılı vakum infiltrasyonu ile daha önce ayrılmış yapraklar18 için optimize edilmiş koşullarla planta geçici ekspresyonunda ilk kez rapor ettik ve burada kakaoda planta geçici ekspresyonunda ilkini rapor ediyoruz.
Protokol
1. Agrobacterium tumefaciens kültürü
- Agrobacterium tumefaciens suşu LBA4404'nin elektroyetkin hücrelerini çözün.
- 1 mL maya malt ekleyin (YM; Tablo 1) 17 mm x 100 mm'lik bir kültür tüpüne et suyu. Bu tüpü daha sonrası için saklayın ve oda sıcaklığında (RT) saklayın.
- 1.5 mL'lik bir mikrofüj tüpüne, 30 μL çözülmüş Agrobacterium hücresi ve 35S:RUBY içeren 100-250 ng (5 μL'ye kadar) DNA ekleyin. Yavaşça karıştırın.
NOT: 35S:RUBY , Yunde Zhao'nun hediyesiydi. Numune arkını önlemek için, iyonik bileşiklerin varlığını mümkün olduğunca azaltın. Bu iyonik bileşikler, DNA19'un etanol çökelmesinden kalan tuzlar olabilir. - Bu noktada, buz üzerine 1 mm'lik bir elektroporasyon küveti yerleştirin.
- Önceki süspansiyon karışımını soğutulmuş 1 mm'lik bir elektroporasyon küvetine aktarın. Her şeyi buz üzerinde tutun. Küvetin metalik elektrotlarını silin.
- Elektroporatörü Agr'ye (2.2 kV, ~5 ms, 1 darbe) ayarlayın. Küveti elektroporasyon odasının içine yerleştirin.
- Darbe düğmesine basın. Nabız parametrelerini kaydedin. Numune ark yaparsa, elektroporasyon işlemi başarısız olur.
NOT: Nabızdan hemen sonra hücrelerin hızlı bir şekilde YM suyuna aktarılması çok önemlidir. Bu aktarımın geciktirilmesi, dönüşüm verimliliğini önemli ölçüde azaltabilir20. - Hücreleri küvetten 17 mm x 100 mm'lik tüpe aktarmak için hemen kaydedilen YM suyunu kullanın. Hücreleri yavaşça yeniden askıya alın.
- Dönüştürülmüş hücreleri bir orbital inkübatörde 28 ° C ve 250 rpm'de 3 saat inkübe edin.
NOT: Bu kültürde antibiyotik yoktur; Uygun aseptik koşullar konusunda dikkatli olun. - Bu kültürü seçici YM agar plakalarınasürün 21. Dönüştürülmüş LBA4404-RUBY suşu için, bu plakaların rifampisin (25 μg/mL), spektinomisin (50 μg/mL) ve streptomisin (50 μg/mL) içerdiğinden emin olun. Bu plakayı gece boyunca 28 °C ayakta duran bir inkübatörde inkübe edin.
NOT: Bu protokolde, spektinomisine (50 μg/mL) karşı bakteriyel direnç sağlayan ve sızan bitki dokusu üzerinde görsel bir raportör olarak işlev gören 35S:RUBY vektörü kullanılmıştır. - Gece kültüründen kolonileri 12.5 mL YM suyu ve Luria Bertani (LB) suyu karışımı (sırasıyla 9:1 oranında), 10 mM MES, pH 5.722 üzerine aşılayın. Bu seçici sıvı ortamın adım 1.10'da kullanılan antibiyotiklerin aynısını içerdiğinden emin olun. Bu ortamların bileşenlerini ve konsantrasyonlarını görmek için Tablo 1'e bakın.
- Agrobacterium'u inkübe ederken, kültür için sıvı hacminin yaklaşık 4 ila 5 katı kadar havalandırma alanı bırakın. Hücre topaklanmasını önlemek için Agrobacterium suşu LBA4404 için YM suyu kullanın23.
- Kültürü 28 ° C'lik bir orbital inkübatörde 250 rpm'de 16 saat inkübe edin.
- Kültürü, adım 1.11'de kullanılan ortamla başlangıç hacminin 10 katına kadar ölçeklendirin.
- Kültürü 28 ° C'lik bir orbital inkübatörde 16 saat ve 250 rpm inkübe edin.
- Gece kültürünü 0,4'lük bir optik yoğunluğa (OD600) ayarlayın. 20 μM asetosiringon (AS) ekleyin.
- OD 600 yaklaşık 1.0'a ulaşana kadar 28 ° C'lik bir orbital inkübatörde250 rpm'de inkübe edin.
- Hücreleri 20 ° C'de 10 dakika boyunca 4 500 x g'da santrifüjleyin.
- Pelet, OD600'ü 0.6'ya ayarlayarak süspansiyon çözeltisi (10 mM MES, 10 mM MgCl2, pH 5.7) ile yeniden süspanse edin. 200 μM AS24 ekleyin.
NOT: Süspansiyon çözeltisini 28 °C'de önceden inkübe edin. Süspansiyon çözeltisi eklendiğinde soğuksa, hücreler çökelir. - Bakteriyel süspansiyonu karanlık koşullarda ve 25 °C'de 2-24 saat bekletin. Ajitasyon gerekli değildir22.
2. Bitki seçimi
- Agroinfiltrasyon için en uygun aşamada yaprakları olan bir dalı olan bir bitki seçin.
NOT: Bitki tam büyümüş veya olgun bir ağaç olabilir. Kakao için C evresinin genç yaprakları tavsiye edilir. Bu yapraklar bronz ila açık yeşil renklidir; tam olarak genişlemiş veya D evresiyaprakları 25 kadar katı değildirler (Şekil 1).- Bir kontrol olarak, kullanılan suş ve vektör için rapor edilen yüksek bir agroinfiltrasyon verimliliği ile diğer bitkiler (örneğin, Nicotiana tabacum) üzerinde aynı anda agroinfiltrasyon gerçekleştirin.
NOT: Bu kontrolde herhangi bir pozitif sonuç alınamazsa, negatif sonuçların suş veya kullanılan vektörden kaynaklanması mümkündür.
- Bir kontrol olarak, kullanılan suş ve vektör için rapor edilen yüksek bir agroinfiltrasyon verimliliği ile diğer bitkiler (örneğin, Nicotiana tabacum) üzerinde aynı anda agroinfiltrasyon gerçekleştirin.
3. Vakum odası kurulumu
- Bir vakum odası olarak, içindeki vakum basıncını ölçmek için vakum ölçere sahip bir desikatör kullanın.
- Adım 1.19'dan itibaren Agrobacterium süspansiyonuna 250 μM Jasmonik asit (JA)18,26 ekleyin.
- Seçilen dalı ve yaprakları daldırmak için Agrobacterium kültürünü geniş ağızlı bir behere aktarın. Ardından, Agrobacterium kültürü içeren kabı desikatörün içine yerleştirin.
- Dalı kurutucu ile kapağı arasına yerleştirin. İstenilen yaprakları Agrobacterium kültürünün içine daldırdığınızdan emin olun. Ardından, bitki dalının desikatöre girmesine izin veren kesikli yuvarlak bir halka olan bir atlama halkası kullanın. Atlama Halkası ayrıca Desikatörün alt ve üst kısmı arasında bir ara parça görevi görür.
- Contanın, kapakla ezilmeyi önleyecek kadar yapısal olarak sağlam, bükülecek ve desikatörün çevresine göre ayarlanacak kadar esnek olduğundan ve gözenekli bir malzemeden yapılmadığından emin olun.
NOT: Bu çalışmada, contaya benzeyen gözeneksiz plastik bir malzeme ile kaplanmış, birlikte bükülmüş birkaç küçük telden oluşan çok telli bir metal tel kullanılmıştır (Şekil 2). - Dalı desikatöre sabitlemek için silikon baskı malzemesi kullanın. Malzemenin yapışkan, gözeneksiz, kimyasal olarak desikatöre ve bitkiye inert olduğundan ve dal, conta ve desikatör arasındaki küçük boşlukları uygulaması ve doldurması kolay olduğundan emin olun.
- Silikon baskı malzemesi polimerize olduğunda (bu yaklaşık 1 dakika sürer) ve dalı yerine sabitlediğinde, desikatörü kapatın. Boşluk bırakmadığınızdan emin olun.
- Kurutucuyu vakum pompasına bağlayın (Şekil 3).
4. Vakum sızması
- Vakum pompasını -0.07 MPa'ya ulaşana kadar çalıştırın.
- Bu basınca ulaştığında, basınç valfini kapatın ve vakum pompasını kapatın. Bu basıncı 5 dakika koruyun.
- Hazne basıncını eski haline getirmek için basınç valfini açın.
NOT: Bu kritik bir adımdır. Hazne basıncını kademeli ve sabit bir şekilde geri yükleyin. Desikatörün tamamen yeniden basınçlandırılması 3 dakika kadar sürebilir. Uzun süreli yeniden basınçlandırma, doku içine sızan bakteri sayısını artırır10. - Bu işlemi iki kez daha tekrarlayın.
- Dalı hücre süspansiyonundan ve desikatörden çıkarın.
- Sızan yaprakları damıtılmış suyla temizleyin.
5. Sızan yaprakların inkübasyonu
- Sızan yaprakların 25 °C'de 48 saat karanlık koşullarda kalmasına izin verin.
- Ardından, sızan dokuyu 16/8 saatlik açık / koyu fotoperiyoda maruz bırakın.
- Enfeksiyondan 3-7 gün sonra (DPI) geçici yaprak dönüşümünü değerlendirin.

Şekil 1: Kakao yapraklarının gelişim aşamaları. (A-E) Gelişim aşamaları25. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
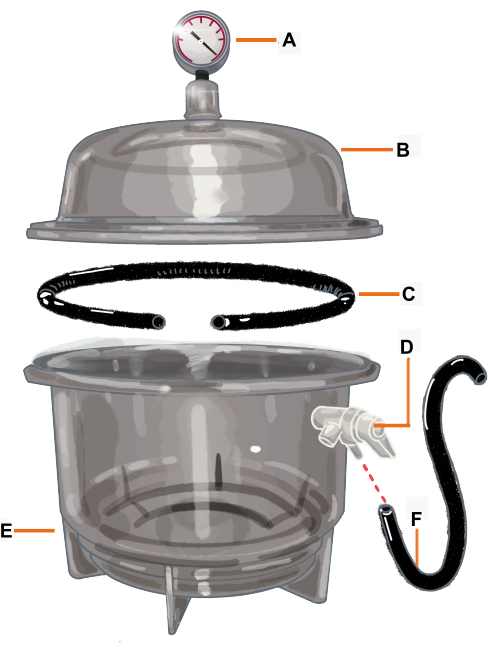
Şekil 2: Vakum odası konfigürasyonu ve bileşenleri. Vakum odası, bir vakum göstergesine bağlı bir desikatördür. Conta / O-ring, dalın yerleştirileceği bir açıklığa sahip olacak şekilde kesilir. (A) Vakum göstergesi, (B) Kapak, (C) Conta / O-ring, (D) Basınç valfi, (E) Desikatör, (F) Hortum. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Planta vakumlu agroinfiltrasyon sisteminde. Sızma işlemi sırasında vakum kayıplarını önlemek için, dalın kurutucuya ve contaya/O-ringe silikon baskı malzemesi ile sabitlenmesi çok önemlidir. (A) Kakao bitkisi, (B) Vakum odası, (C) Silikon baskı malzemesi, (D) Agrobacterium süspansiyonuna batırılmış yapraklar, (E) Vakum pompası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bu protokol, büyük boyutlu odunsu bitkiler için etkili bir agroinfiltrasyon yöntemi sunar. Bu protokolle, -0,07 MPa'lık bir vakum basıncı elde edebildik, bu da kakao yapraklarının etkili, lokalize infiltrasyonu ile sonuçlandı. Şekil 4'te, sızma sistemi kurulum sürecini ve Şekil 5'te son yapılandırmayı gözlemliyoruz.
Tartışmalar
Bu çalışmada, örnek olarak kakao bitkilerini kullanarak, odunsu bitkilerin planta geçici dönüşümü için verimli, düşük maliyetli bir agroinfiltrasyon protokolü sunduk. Yaprakların kütikülünün bitki dokularının dönüşümü için temsil ettiği iyi bilinen kısıtlama göz önüne alındığında, genellikle bu prosedüre karşı inatçı olan odunsu bitkilerde vakumla agroinfiltrasyonu kolaylaştırmak için bir strateji geliştirmeye odaklandık.
Vakum odası i?...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Lic'e teşekkür ederiz. Jesús Fuentes González ve Néstor Iván Robles Olivares'e video görüntülerinin çekilmesindeki yardımları için. CIATEJ'den (Theobroma kakao bitkileri) Dr. Antonia Gutierrez Mora'nın cömert armağanlarını kabul ediyoruz. Ayrıca tesis desteği için CIATEJ ve Laboratorio Nacional PlanTECC, México'ya teşekkür ederiz. H.E.H.D. (CVU: 1135375), Consejo Nacional de Humanidades, Ciencia y Tecnología, México (CONAHCYT) tarafından finanse edilen yüksek lisans çalışmaları yürütmüştür. R.U.L., Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) ve Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, México (Hibe 7270-2018) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Referanslar
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır