Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Вакуум-принудительная агроинфильтрация для трансформации in planta непокорных растений: какао как тематическое исследование
В этой статье
Резюме
Здесь мы представляем первый протокол локализованной вакуумной инфильтрации для исследований in vivo генетической трансформации крупномерных растений. Используя эту методологию, мы впервые добились Agrobacterium-опосредованной в planta транзиторной трансформации какао.
Аннотация
Переходная трансформация растений является быстрой и экономичной альтернативой генетической трансформации растений. Большинство протоколов трансформации in planta основаны на использовании трансформации, опосредованной агробактериями. Тем не менее, используемые в настоящее время протоколы стандартизированы для малогабаритных установок из-за физических и экономических ограничений, связанных с вакуумной обработкой крупногабаритных установок. В данной работе представлен эффективный протокол локализованной вакуумной агроинфильтрации, адаптированный для крупнокалиберных растений. Для оценки эффективности предложенного метода мы протестировали его применение на растениях какао – тропическом виде растений, невосприимчивом к генетической трансформации. Наш протокол позволял применять вакуум до 0,07 МПа, с повторениями, к локализованной надземной части листьев какао, что позволяло форсировать инфильтрацию Agrobacterium в межклеточные пространства прикрепленных листьев. В результате мы добились Agrobacterium-опосредованной транзиентной трансформации planta прикрепленных листьев какао, экспрессирующей для репортерной системы RUBY. Это также первый случай транзиторной трансформации какао, опосредованный агробактериями. Этот протокол позволит применить метод вакуумной агроинфильтрации к другим видам растений с аналогичными размерными ограничениями и откроет дверь для характеристики генов in planta у непокорных древесных крупноразмерных видов.
Введение
Методы генетической трансформации растений имеют важное значение для проверки биологических функций генов и особенно полезны сегодня, учитывая большое количество неохарактеризованных генов, предсказанных в постгеномнуюэпоху. Эти методы могут быть использованы для получения полностью трансформированных линий или для экспрессии генов на переходной основе. Стабильная трансформация происходит, когда чужеродная ДНК, принятая хозяином, полностью и необратимо интегрируется в геном хозяина, и генетические модификации передаются последующим поколениям. Транзиторная экспрессия, известная как транзиторная трансформация, происходит из нескольких копий Т-ДНК, перенесенных агробактериями в клетку, которые не были интегрированы в геном хозяина, и достигает пика через 2-4 дняпосле заражения.
Стоит отметить, что анализы транзиторной экспрессии часто достаточны для функциональной характеристики генов и могут предложить ряд преимуществ по сравнению со стабильной трансформацией. Например, транзиторная трансформация не требует процедур регенерации на основе культуры тканей. Еще одно преимущество заключается в том, что он совместим с функциональным анализом генов in planta , существующим несколькими успешными примерами протоколов, хорошо стандартизированных для модельных видов растений, таких как Arabidopsis thaliana3 и Nicotiana benthamiana4, но все еще ограниченных для немодельных видов5.
Развитие транзиторных анализов зависит от наличия эффективных методов переноса генов. Для этого наиболее популярные подходы основаны на инфильтрации Agrobacterium , которая использует уникальную способность Agrobacterium переносить ДНК в клетки растений6. Другим полезным инструментом для такого анализа является использование репортерных генов, таких как зеленые флуоресцентные белки (GFP), β-глюкуронидаза (GUS), люцифераза или RUBY, которые используются для отслеживания трансформационных событий. Среди этих репортерных систем RUBY в настоящее время является самой простой для визуализации и основана на превращении тирозина в беталаины посредством трех ферментативных реакций. В отличие от других репортерных систем, полученные беталаины можно легко наблюдать в виде ярко окрашенных пигментов на трансформированных растительных тканях без необходимости использования сложного оборудования или дополнительных реагентов7.
При инфильтрации суспензии Agrobacterium в межклеточное пространство мезофилла листа наиболее критическим этапом для успешной агроинфекции является преодоление физического барьера, накладываемого эпидермальной кутикулой листьев8. В то время как для некоторых растений градиент давления, создаваемый безыгольным шприцем (шприцевая агроинфильтрация), достаточен для эффективной агроинфильтрации, как это происходит у Nicotiana benthamiana9, другим видам растений может потребоваться больший градиент давления, например, тот, который создается с помощью вакуумных насосов10. При вакуумных процессах агроинфильтрация происходит в два этапа. В первом случае вакуум служит для того, чтобы подвергнуть растительный материал пониженному давлению, заставляя выделять газы из воздушных пространств мезофилла через устьица и раны. Затем, во время фазы регерметизации, суспензия Agrobacterium проникает в межклеточные пространства через устьица и ранит11.
По сравнению с инфильтрацией шприцем, вакуумная инфильтрация обеспечивает более высокую частоту использования, воспроизводимость и возможность контролировать давление и продолжительность на каждом этапе процесса инфильтрации10. В листьях различных видов растений, таких как шпинат (Spinacia oleracea)12, пион (древесный многолетник) (Paeonia ostii)13 и вигна (Vigna unguiculata)14, протоколы вакуумной агроинфильтрации достигали более высокой скорости инфильтрации, чем инфильтрация шприцем. Аналогичным образом, у томатов (Lycopersicon esculentum)15 и гербер (Gerbera hybrida)16 вакуумная агроинфильтрация приводила к более сильному и равномерному подавлению генов, чем шприцевая инфильтрация. Дополнительным преимуществом вакуумной инфильтрации является меньшая зависимость от генотипа по сравнению со шприцевой инфильтрацией, которая недавно наблюдалась у трех сортов цитрусовых (Fortunella obovata, Citrus limon и C. grandis)17. Однако при попытке применить вакуумную агроинфильтрацию к растениям, которые слишком велики, чтобы поместиться в эксикаторы, размер вакуумных камер может быть ограничением, как это обычно происходит с тропическими древесными растениями.
Ниже мы опишем протокол, который преодолевает пространственные ограничения вакуумных камер, проверяя его полезность для переходной трансформации листьев какао in planta . Мы представляем первый локализованный метод вакуумной инфильтрации какао, который не требует дополнительного оборудования и даже позволяет использовать те же лабораторные эксикаторы, что и для инфильтрации всего растения, но с простой адаптацией, позволяющей получить доступ к части растения внутри вакуумной камеры, что позволяет использовать его на разных стадиях развития растения. Чтобы проверить полезность предложенного метода локализованной вакуумной инфильтрации, мы выбрали какао в качестве аналога крупнолистного тропического вида растений, который трудно трансформировать. Используя этот метод локализованной инфильтрации, мы недавно сообщили о первой транзиторной экспрессии растений в авокадо путем вакуумной инфильтрации, опосредованной агробактериями, с условиями, ранее оптимизированными для отделившихся листьев18, и здесь мы сообщаем о первой транзиторной экспрессии в planta у какао.
протокол
1. Культура Agrobacterium tumefaciens
- Размораживание электрокомпетентных клеток штамма Agrobacterium tumefaciens LBA4404.
- Добавьте 1 мл дрожжевого солода (YM; Таблица 1) бульон в культуральную пробирку размером 17 мм х 100 мм. Сохраните эту пробирку на потом и храните при комнатной температуре (RT).
- В пробирку с микрофугой объемом 1,5 мл добавляют 30 мкл размороженных клеток Agrobacterium и 100-250 нг (до 5 мкл) ДНК, содержащей 35S:RUBY. Аккуратно перемешайте.
ПРИМЕЧАНИЕ: 35S:RUBY был подарком от Юньдэ Чжао. Чтобы избежать возникновения дуги в образце, максимально уменьшите присутствие ионных соединений. Эти ионные соединения могут быть остаточными солями, образующимися в результате осаждения этанолом ДНК19. - На этом этапе поместите на лед электропорационную кювету диаметром 1 мм.
- Перелейте предыдущую суспензионную смесь в охлажденную кювету для электропорации диаметром 1 мм. Держите все на льду. Протрите металлические электроды кюветы.
- Установите электропоратор на Agr (2,2 кВ, ~5 мс, 1 импульс). Поместите кювету внутрь электропорационной камеры.
- Нажмите кнопку Pulse . Зарегистрируйте параметры импульса. Если на образце вспыхнула дуга, процесс электропорации не удался.
ПРИМЕЧАНИЕ: Очень важно быстро перенести клетки в бульон YM сразу после импульса. Отсрочка этого переноса может резко снизить эффективность преобразования20. - Немедленно используйте сэкономленный бульон YM для переноса клеток из кюветы в пробирку размером 17 мм x 100 мм. Аккуратно ресуспендируйте клетки.
- Инкубируют трансформированные клетки в течение 3 ч при 28 °C и 250 об/мин на орбитальном инкубаторе.
ПРИМЕЧАНИЕ: Эта культура не содержит антибиотиков; Будьте осторожны с надлежащими асептическими условиями. - Нанесите эту культуру на селективные агаровые пластины YM21. Для трансформированного штамма LBA4404-RUBY убедитесь, что эти планшеты содержат рифампицин (25 мкг/мл), спектиномицин (50 мкг/мл) и стрептомицин (50 мкг/мл). Инкубируйте эту пластину в течение ночи в инкубаторе со стоячей температурой 28 °C.
ПРИМЕЧАНИЕ: В этом протоколе использовался вектор 35S:RUBY , который придает устойчивость бактерий к спектиномицину (50 мкг/мл) и функционирует как визуальный репортер на инфильтрированных растительных тканях. - Высевают колонии из ночной культуры на 12,5 мл смеси отвара YM и бульона Luria Bertani (LB) (в пропорции 9:1 соответственно), 10 мМ MES, pH 5,722. Убедитесь, что эта селективная жидкая среда содержит те же антибиотики, которые использовались на шаге 1.10. В таблице 1 приведены ингредиенты и концентрации этих сред.
- При инкубации агробактерий оставьте для культуры достаточно места для аэрации, примерно в 4-5 раз превышающее объем жидкости. Используйте отвар YM для LBA4404 штамма Agrobacterium , чтобы избежать слипания клеток23.
- Инкубируют культуру в течение 16 ч при 250 об/мин на орбитальном инкубаторе с температурой 28 °C.
- Увеличьте культуру до 10 раз по сравнению с исходным объемом с помощью той же среды, которая использовалась на шаге 1.11.
- Инкубируют культуру в течение 16 ч при 250 об/мин на орбитальном инкубаторе с температурой 28 °C.
- Отрегулируйте ночную культуру до оптической плотности (OD600), равной 0,4. Добавьте 20 мкМ ацетосирингона (АС).
- Инкубируйте при 250 об/мин на орбитальном инкубаторе с температурой 28 °C, пока наружный диаметр600 не достигнет примерно 1,0.
- Центрифугируют клетки при 4 500 x g в течение 10 мин при 20 °C.
- Ресуспендируйте гранулы с помощью суспензионного раствора (10 мМ MES, 10 мМ MgCl2, pH 5,7), регулируя наружный диаметр600 до 0,6. Добавьте 200 мкМ AS24.
ПРИМЕЧАНИЕ: Предварительно инкубируйте раствор суспензии при температуре 28 °C. Если суспензионный раствор при добавлении холодный, клетки выпадут в осадок. - Оставьте бактериальную суспензию на 2-24 ч в темных условиях и при температуре 25 °C. Агитация не требуется22.
2. Выбор растения
- Выбирайте растение с веткой с листьями в оптимальной стадии для агроинфильтрации.
ПРИМЕЧАНИЕ: Растение может быть взрослым или взрослым деревом. Для какао рекомендуются молодые листья стадии С. Эти листья имеют бронзовый или светло-зеленый цвет; они не полностью расширены и не так жестки, как листьястадии D 25 (рис. 1).- В качестве контроля одновременно проводят агроинфильтрацию на других растениях (например, Nicotiana tabacum) с высокой эффективностью агроинфильтрации, которая сообщается для используемого штамма и переносчика.
ПРИМЕЧАНИЕ: Если в этом контроле не получено положительных результатов, возможно, отрицательные результаты связаны с деформацией или используемым вектором.
- В качестве контроля одновременно проводят агроинфильтрацию на других растениях (например, Nicotiana tabacum) с высокой эффективностью агроинфильтрации, которая сообщается для используемого штамма и переносчика.
3. Настройка вакуумной камеры
- В качестве вакуумной камеры используйте эксикатор с вакуумметром для измерения вакуумного давления внутри.
- Добавьте 250 мкМ жасмоновой кислоты (JA)18,26 к суспензии Agrobacterium, начиная с шага 1.19.
- Перенесите культуру Agrobacterium в стакан с широким горлышком, чтобы погрузить выбранную ветку и листья. Затем поместите стакан с культурой Agrobacterium внутрь эксикатора.
- Поместите ветку между эксикатором и его крышкой. Обязательно погрузите желаемые листья внутрь культуры Agrobacterium . Далее используют прыгающее кольцо, которое представляет собой круглое кольцо с вырезом, позволяющим ветке растения входить в эксикатор. Прыгающее кольцо также действует как прокладка между нижней и верхней частями сушильщика.
- Убедитесь, что прокладка достаточно стабильна, чтобы избежать сдавливания крышкой, достаточно гибкая, чтобы сгибаться и регулироваться по окружности эксикатора, и не изготовлена из пористого материала.
ПРИМЕЧАНИЕ: В этом исследовании использовался многожильный металлический провод, состоящий из нескольких скрученных вместе проволок меньшего размера, покрытых непористым пластиковым материалом, напоминающим прокладку (Рисунок 2). - Чтобы закрепить ветку на эксикаторе, используйте силиконовый оттискной материал. Убедитесь, что материал липкий, непористый, химически инертный к эксикатору и растению, а также легко наносится и заполняет небольшие зазоры между ветвью, прокладкой и эксикатором.
- Как только силиконовый оттискной материал полимеризуется (это занимает около 1 минуты) и закрепит ветку на месте, закройте эксикатор. Следите за тем, чтобы не оставалось зазоров.
- Подключите эксикатор к вакуумному насосу (Рисунок 3).
4. Вакуумная инфильтрация
- Запускайте вакуумный насос до тех пор, пока он не достигнет -0,07 МПа.
- Как только он достигнет этого давления, закройте напорный клапан и выключите вакуумный насос. Поддерживайте это давление в течение 5 минут.
- Откройте напорный клапан, чтобы восстановить давление в камере.
ПРИМЕЧАНИЕ: Это очень важный шаг. Постепенно и неуклонно восстанавливайте давление в камере. Для полного повышения давления в эксикаторе может потребоваться до 3 минут. Длительное повторное давление увеличивает количество бактерий, проникающих внутрь ткани10. - Повторите этот процесс еще два раза.
- Снимите ветку с клеточной суспензии и эксикатора.
- Пропитанные листья промыть дистиллированной водой.
5. Инкубация инфильтрированных листьев
- Оставьте инфильтрированные листья в темных условиях при температуре 25 °C в течение 48 часов.
- Затем подвергните инфильтрированную ткань 16/8-часовому световому/темному фотопериоду.
- Оцените транзиторную трансформацию листьев через 3-7 дней после заражения (DPI).

Рисунок 1: Какао покидает стадии развития. (А-Е) Стадии развития25. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
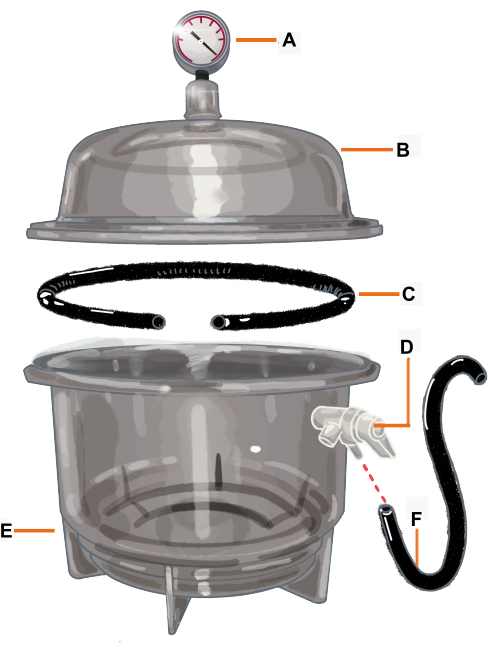
Рисунок 2: Конфигурация вакуумной камеры и ее компонентов. Вакуумная камера представляет собой эксикатор, соединенный с вакуумметром. Прокладка / уплотнительное кольцо обрезается таким образом, чтобы в нем было отверстие, куда будет помещена ветка. (A) Вакуумметр, (B) Крышка, (C) Прокладка / уплотнительное кольцо, (D) Напорный клапан, (E) Сушилка, (F) Шланг. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: В системе вакуумной агроинфильтрации planta . Чтобы избежать потерь вакуума в процессе инфильтрации, очень важно закрепить ответвление на эксикаторе и прокладку/уплотнительное кольцо силиконовым оттискным материалом. (A) Растение какао, (B) Вакуумная камера, (C) Силиконовый оттискной материал, (D) Листья, погруженные в суспензию Agrobacterium , (E) Вакуумный насос. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Данный протокол представляет собой эффективный метод агроинфильтрации для крупноплодных древесных растений. С помощью этого протокола мы смогли достичь вакуумного давления -0,07 МПа, что привело к эффективной, локализованной инфильтрации листьев какао. На рисунке 4 пок?...
Обсуждение
В этой работе мы представили эффективный, недорогой протокол агроинфильтрации для переходной трансформации древесных растений in planta на примере растений какао. Учитывая хорошо известное ограничение, которое кутикула листьев представляет для трансформации тканей растений, мы сос...
Раскрытие информации
Авторы не могут заявить о конфликте интересов.
Благодарности
Мы благодарим Lic. Хесусу Фуэнтесу Гонсалесу и Нестору Ивану Роблесу Оливаресу за помощь в съемках видеоматериала. Мы выражаем признательность доктору Антонии Гутьеррес Мора (Antonia Gutierrez Mora) из CIATEJ (растения какао Theobroma ). Мы также благодарим CIATEJ и Laboratorio Nacional PlanTECC, Мексика, за поддержку объекта. H.E.H.D. (CVU: 1135375) проводил магистерские исследования при финансовой поддержке Consejo Nacional de Humanidades, Ciencia y Tecnología, México (CONAHCYT). R.U.L. выражает благодарность за поддержку со стороны Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) и Secretaría de Innovación Ciencia y Tecnología (SICYT), Халиско, Мексика (грант 7270-2018).
Материалы
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Ссылки
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены