A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זרימת עבודה ניסיונית וניתוח נתונים עבור ננו-אינדנציה של חומר רך
In This Article
Summary
הפרוטוקול מציג זרימת עבודה מלאה לניסויים בננו-אינדנציה של חומרים רכים, כולל הידרוג'לים ותאים. ראשית, מפורטים הצעדים הניסיוניים לרכישת נתוני ספקטרוסקופיית כוח; לאחר מכן, הניתוח של נתונים כאלה מפורט באמצעות תוכנת Python קוד פתוח שפותחה לאחרונה, אשר ניתן להוריד בחינם מ- GitHub.
Abstract
ננו-אינדנטציה מתייחסת לקבוצה של טכניקות ניסיוניות שבהן נעשה שימוש בגשושית כוח מיקרומטרית כדי לכמת את התכונות המכניות המקומיות של ביו-חומרים ותאים רכים. גישה זו קיבלה תפקיד מרכזי בתחומי המכנוביולוגיה, תכנון ביו-חומרים והנדסת רקמות, כדי להשיג אפיון מכני נכון של חומרים רכים ברזולוציה דומה לגודלם של תאים בודדים (μm). האסטרטגיה הפופולרית ביותר לרכישת נתונים ניסיוניים כאלה היא להשתמש במיקרוסקופ כוח אטומי (AFM); בעוד שמכשיר זה מציע רזולוציה חסרת תקדים בכוח (עד pN) ובמרחב (תת-ננומטר), השימושיות שלו מוגבלת לעתים קרובות על ידי המורכבות שלו המונעת מדידות שגרתיות של אינדיקטורים אינטגרליים של תכונות מכניות, כגון מודולוס של יאנג (E). דור חדש של ננו-אינדנטרים, כגון אלה המבוססים על טכנולוגיית חישת סיבים אופטיים, צבר לאחרונה פופולריות בזכות קלות האינטגרציה שלו תוך שהוא מאפשר להפעיל כוחות תת-nN ברזולוציה מרחבית של מיקרומטר, ולכן הוא מתאים לחקור תכונות מכניות מקומיות של הידרוג'לים ותאים.
בפרוטוקול זה מוצג מדריך שלב אחר שלב המפרט את ההליך הניסויי לרכישת נתוני ננו-אינדנטנציה על הידרוג'לים ותאים באמצעות ננו-אינפנטר חישת סיבים אופטיים זמין מסחרית. בעוד שחלק מהצעדים הם ספציפיים למכשיר המשמש כאן, ניתן לקחת את הפרוטוקול המוצע כמדריך למכשירי ננו-אינדנטציה אחרים, שכן חלק מהצעדים מותאמים בהתאם להנחיות היצרן. יתר על כן, מוצגת תוכנת Python חדשה בקוד פתוח המצוידת בממשק משתמש גרפי ידידותי למשתמש לניתוח נתוני ננו-אינדנציה, המאפשרת סינון של עקומות שנרכשו באופן שגוי, סינון נתונים, חישוב נקודת המגע באמצעות הליכים מספריים שונים, חישוב קונבנציונלי של E, כמו גם ניתוח מתקדם יותר המתאים במיוחד לנתוני ננו-כניסה של תא יחיד.
Introduction
תפקידה הבסיסי של המכניקה בביולוגיה נקבע כיום 1,2. מרקמות שלמות לתאים בודדים, תכונות מכניות יכולות להודיע על המצב הפתופיזיולוגי של החומר הביולוגי הנחקר 3,4. לדוגמה, רקמת שד המושפעת מסרטן נוקשה יותר מרקמה בריאה, מושג המהווה את הבסיס למבחן המישוש הפופולרי5. יש לציין כי לאחרונה הוכח כי מחלת נגיף הקורונה 2019 (COVID-19) הנגרמת על ידי תסמונת נשימתית חריפה חמורה נגיף קורונה 2 (SARS-CoV-2) מודגשת על ידי שינויים בתכונות המכניות של תאי הדם, כולל ירידה בעיוות אריתרוציטים וירידה בנוקשות לימפוציטים ונויטרופילים בהשוואה לתאי דם של אנשים תמימים SARS-CoV-26.
באופן כללי, המכניקה של תאים ורקמות שזורה מטבעה: לכל רקמה יש תכונות מכניות ספציפיות המשפיעות בו זמנית ותלויות באלה של התאים המרכיבים ומטריצה חוץ-תאית (ECM)5. מסיבה זו, אסטרטגיות לחקר מכניקה בביולוגיה כוללות לעתים קרובות מצעים הנדסיים עם גירויים מכניים רלוונטיים מבחינה פיזיולוגית כדי להבהיר את התנהגות התאים בתגובה לגירויים אלה. לדוגמה, עבודת היסוד של אנגלר ועמיתיו הראתה כי מחויבות לרירית תאי גזע מזנכימליים נשלטת על ידי גמישות מטריצה, כפי שנחקר על הידרוג'לים פוליאקרילאמיד דו-ממדיים רכים ונוקשים (PAAm)7.
קיימות אסטרטגיות רבות לאפיון מכני של החומר הביולוגי הנחקר, המשתנות בקנה מידה מרחבי (כלומר, מקומי לתפזורת) ובאופן העיוות (למשל, צירי לעומת גזירה), וכתוצאה מכך מניבות מידע שונה, הדורש פרשנות זהירה 3,8,9,10. המכניקה של ביו-חומרים רכים מתבטאת בדרך כלל במונחים של קשיחות. עם זאת, קשיחות תלויה הן בתכונות החומר והן בגאומטריה, בעוד שמודולים אלסטיים הם תכונות יסוד של חומר ואינם תלויים בגאומטריה של החומר11. ככזה, מודולים אלסטיים שונים קשורים לנוקשות של דגימה נתונה, וכל מודולוס אלסטי מקיף את עמידות החומר למצב מסוים של דפורמציה (למשל, צירי לעומת גזירה) בתנאי גבול שונים (למשל, התפשטות חופשית לעומת כליאה)11,12. ניסויי ננו-אינדנטציה מאפשרים כימות של תכונות מכניות באמצעות ה-E הקשור לעיוות חד-אקסיאלי (כניסה) כאשר החומר הביולוגי אינו מוגבל לרוחב10,11,12.
השיטה הפופולרית ביותר לכימות E של מערכות ביולוגיות בקנה מידה מיקרו היא AFM13,14,15,16. AFM הוא כלי חזק ביותר עם רזולוציית כוח עד לרמת pN ורזולוציה מרחבית עד לסולם תת-ננומטר. יתר על כן, AFM מציעה גמישות קיצונית במונחים של צימוד עם כלים אופטיים ומכניים משלימים, ומרחיבה את יכולותיה לחלץ שפע של מידע מהחומר הביולוגי הנחקר13. עם זאת, תכונות אטרקטיביות אלה מגיעות עם מחסום כניסה המיוצג על ידי המורכבות של מערך הניסוי. AFM דורש הכשרה מקיפה לפני שמשתמשים יכולים לרכוש נתונים חזקים, והשימוש בו לאפיון מכני יומיומי של חומרים ביולוגיים הוא לעתים קרובות לא מוצדק, במיוחד כאשר הכוח הייחודי שלו והרזולוציות המרחביות אינם נדרשים.
מסיבה זו, סוג חדש של ננו-אינדנטנטים צבר לאחרונה פופולריות בשל קלות השימוש בהם, תוך שהוא עדיין מציע נתונים דומים ל-AFM עם רזולוציית כוח תת-nN ורזולוציה מרחבית של μm, המשקפת כוחות המופעלים ונתפסים על ידי תאים על פני סולמות אורך רלוונטיים2. במיוחד, התקני ננו-אינדנטנציה המבוססים על טכנולוגיית חישת סיבים אופטיים17,18 צברו פופולריות בקרב חוקרים הפעילים בתחום המכנוביולוגיה ומחוצה לה; ופורסמו שפע של עבודות המדווחות על התכונות המכניות של ביו-חומרים המשתמשים במכשירים אלה, כולל תאים19,20, הידרוג'לים 8,21 ורקמות 22,23. למרות היכולות של מערכות אלה לחקור תכונות מכניות דינמיות מקומיות (כלומר, מודולוס אחסון ואובדן), ניסויים מעין סטטיים המניבים E נשארים הבחירה הפופולרית ביותר 8,19,20,21. בקצרה, ניסויי ננו-אינדנטנציה מעין-סטטיים מורכבים מהסטת הדגימה במהירות קבועה עד לנקודה מוגדרת על ידי תזוזה, כוח או עומק כניסה מרביים, ורישום הכוח והמיקום האנכי של הקנטילבר בעקומות הנקראות מרחק-כוח (F-z). לאחר מכן, עקומות F-z מומרות לעקומות כניסת כוח (F-δ) באמצעות זיהוי נקודת המגע (CP), ומצוידות במודל מכניקת מגע מתאים (בדרך כלל מודלהרץ 13) לחישוב E.
בעוד שפעולתם של ננו-אינדנטנטים בעלי ראש ברזל דומה למדידות AFM, ישנן תכונות שכדאי לקחת בחשבון. בעבודה זו, מדריך שלב אחר שלב לרכישה איתנה של עקומות F-z מתאים והידרוג'לים המחקים רקמות באמצעות ננו-ננו-אינדנטר בעל ראש פרולה זמין מסחרית, על מנת לעודד סטנדרטיזציה של הליכים ניסיוניים בין קבוצות מחקר המשתמשות בהתקן זה ובמכשירים דומים אחרים. בנוסף, ניתנות עצות כיצד להכין בצורה הטובה ביותר דגימות הידרוג'ל ותאים לביצוע ניסויי ננו-אינדנציה, יחד עם טיפים לפתרון בעיות לאורך מסלול הניסוי.
יתר על כן, חלק גדול מהשונות בתוצאות ננו-אינדנציה (כלומר, E וההתפלגות שלו) תלוי בהליך הספציפי המשמש לניתוח נתונים, שאינו טריוויאלי. כדי לטפל בבעיה זו, מסופקות הוראות לשימוש בתוכנת קוד פתוח שפותחה לאחרונה המתוכנתת ב- Python ומצוידת בממשק משתמש גרפי ידידותי למשתמש (GUI) לניתוח אצווה של עקומות F-z . התוכנה מאפשרת סינון נתונים מהיר, סינון נתונים, חישוב של CP באמצעות הליכים מספריים שונים, החישוב הקונבנציונלי של E, כמו גם ניתוח מתקדם יותר בשם ספקטרום האלסטיות24, המאפשר להעריך את המודולוס של יאנג בתפזורת התא, מודולוס יאנג של קליפת אקטין ועובי קליפת אקטין של קליפת המוח. ניתן להוריד את התוכנה באופן חופשי מ- GitHub וניתן להתאים אותה בקלות לניתוח נתונים שמקורם במערכות אחרות על ידי הוספת מנתח נתונים מתאים. יודגש כי פרוטוקול זה יכול לשמש עבור התקני ננו-אינדנטציה אחרים, והתקני ננו-אינדנטציה אחרים באופן כללי, שכן חלק מהצעדים מותאמים בהתאם להנחיות המכשיר הספציפי. הפרוטוקול מסוכם באופן סכמטי באיור 1.
Protocol
1. הכנת מצעים/תאים למדידות ננו-אינדנטציה
- בצע את השלבים המפורטים בפרוטוקול המשלים להכנת הידרוג'לים/תאים של PAAm לניסויים בננו-אינדנטנציה. ההליך מסוכם באיור 2.
הערה: הידרוג'לים של PAAm נבחרו מכיוון שהם ההידרוג'לים הנפוצים ביותר המשמשים בתחום המכנוביולוגיה. עם זאת, הפרוטוקול חל באותה מידה על כל סוג של הידרוג'ל25 (ראה דיון, שינויים בשיטה).
2. הפעלת המכשיר, בחירת הבדיקה וכיול הבדיקה
- בצע את השלבים המפורטים בפרוטוקול המשלים להפעלת המכשיר. לקבלת פרטים טכניים על פעולתם של ננו-אינדנטים בעלי סיבים אופטיים, עיין בהפניות אלה17,18.
- בחר את בדיקת הננו-כניסה כמתואר להלן.
הערה: כל הגשושיות הזמינות מסחרית, כמו אלה המשמשות בפרוטוקול זה, מצוידות בקצה כדורי (איור 3A). לכן, הבחירה מצטמצמת לשני משתנים: קשיחותו של הקנטיליבר ורדיוס הקצה (איור 3B).- בחר את הנוקשות של cantilever (k ב- N/m) התואמת את קשיחות המדגם הצפויה לקבלת התוצאות הטובות ביותר15 (ראה איור 3C ודיון, שלבים קריטיים בפרוטוקול). עבור תאים, בחר בדיקה עם k בטווח 0.01-0.09 N/m. עבור הידרוג'לים, בחר בדיקה עם k בטווח 0.1-0.9 N/m, אשר מניבה תוצאות אופטימליות עבור ג'לים עם E צפוי בין כמה kPa ל- 100 kPa (ראה תוצאות מייצגות).
- בחר את רדיוס הקצה (R ב- μm) בהתאם לרזולוציה המרחבית הרצויה של תהליך הכניסה. עבור תאים קטנים כגון תאי כליה עוברית אנושית 293T (HEK293T) (קוטר ממוצע של ~ 10-15 מיקרומטר26) בחר כדור עם R = 3 מיקרומטר. עבור הידרוג'לים, בחר כדור עם R = 10-250 מיקרומטר כדי לחקור את התכונות המכניות של החומר הביולוגי על פני שטח מגע גדול ולהימנע מהטרוגניות מקומית.
- עיין באיור 3C ובכל הנחיות יצרן נוספות כדי לבחור את הבדיקה המתאימה.
- לאחר בחירת הגשושית, בצע את השלבים בפרוטוקול המשלים כדי להרכיב אותה על הננו-אינדנטר.
3. כיול בדיקה
הערה: השלבים הבאים הם ספציפיים להתקני ננו-אינדנטנציה של פרולה המבוססים על טכנולוגיית חישת סיבים אופטיים, והם מפורטים עבור גרסת התוכנה 3.4.1. עבור התקני ננו-כניסה אחרים, בצע את השלבים המומלצים על-ידי יצרן ההתקן.
- בחלון הראשי של התוכנה, לחץ על אתחול. יופיע תפריט כיול. הזן את פרטי הבדיקה (ניתן למצוא בצד תיבת הגשושית; k ב-N/m, R ב-μm ומקדם הכיול באוויר) בתיבות הקלט.
- הכינו את צלחת הכיול: צלחת פטרי מזכוכית עבה עם תחתית שטוחה (ראו דיון, שלבים קריטיים בפרוטוקול). ממלאים את המנה באותו מדיום כמו צלחת המדגם (זה יכול להיות גם אוויר). התאם את הטמפרטורה של המדיום לזו של הדגימה.
- מניחים את צלחת הכיול מתחת לבדיקה. במידת הצורך, החליקו את הבדיקה ממחזיק הזרוע של הננו-אינדנטר והחזיקו אותה ביד אחת כדי לפנות מקום למיקום צלחת הכיול. החלק בחזרה את הבדיקה למקומה.
- בצע את שני השלבים הבאים לכיול בנוזל. אם מודדים באוויר, השתמשו במצע הפוליטטרה-פלואורואתילן המסופק לכיול ודלגו לשלב 5.
- מקדימים את הבדיקה עם טיפה של 70% אתנול באמצעות פיפטה פסטר עם קצה הפיפטה במגע קל עם ברזל הזכוכית, כדי שהטיפה תחליק על הקצה הכדורי27 (ראה דיון, שלבים קריטיים בפרוטוקול).
- החליקו ידנית את זרועו של הננו-אינדנטר כלפי מטה עד שהגשושית שקועה לחלוטין, אך עדיין הרחק מתחתית צלחת הפטרי. במידת הצורך, הוסיפו עוד מדיום לצלחת הכיול. המתן 5 דקות כדי להגיע לתנאי שיווי משקל בנוזל.
- בתפריט Initialize של התוכנה, לחץ על סרוק אורך גל. המסך של האינטרפרומטר יציג מד התקדמות וחלון האות החי בתוכנת המחשב יציג את התבנית המוצגת באיור S1A, משמאל. כדי לבדוק אם הסריקה האופטית הצליחה, נווט אל החלונית סריקת אורך גל בתיבת האינטרפרומטר. אם הוא מצליח, גל סינוס אמור להיות גלוי לעין (איור 1A, מימין). ראה דיון (פתרון בעיות של השיטה) אם מופיעה שגיאה.
- בתפריט אתחול , לחץ על Find Surface, אשר יוריד בהדרגה את הבדיקה עד שתגיע לסף מוגדר בכיפוף הקנטילבר. הגשושית מפסיקה לזוז כאשר נוצר מגע עם צלחת פטרי הזכוכית.
- בדוק אם הבדיקה נמצאת במגע עם פני השטח. הזז את הבדיקה למטה ב-1 מיקרומטר באמצעות לחצן החץ y כלפי מטה בחלון הראשי של התוכנה. שימו לב לאות הירוק (הסטייה של cantilever) בחלון החי של התוכנה לשינויים בקו הבסיס עם כל שלב, כאשר הקנטילבר נמצא במגע עם המצע (איור S1B). אם אין שינוי, המתקן אינו נמצא בקשר (ראה השלב הבא).
- הגדל את ערך הסף בתפריט אפשרויות תחת הכרטיסיה חפש משטח מערך ברירת המחדל שלו של 0.01 בשלב של 0.01 בכל פעם וחזור על שלב Find Surface עד ליצירת קשר. לחלופין, הורידו את הגשושית למגע בצעדים קטנים של 1 מיקרומטר עד שקו הבסיס הירוק יתחיל לזוז בכל צעד כלפי מטה.
הערה: עבור ה- cantilevers הרכים ביותר (k = 0.025 Nm-1), הגדל את ערך הסף בתפריט אפשרויות תחת הכרטיסיה חפש משטח מראש של ביצוע שלב 6. התחל מערך סף של 0.06 או 0.07 והגדל אותו עד 0.1 במידת הצורך. הסיבה לכך היא שסביר להניח שרעש סביבתי יגרום לשקע להתכופף מעל הסף לפני המגע. עבור בדיקות רכות, הפחתת מהירות הגישה (μm/s) באותו תפריט משפרת גם היא את ההליך. - בתפריט אתחול , לחץ על כיול.
- בדוק את חלון האות החי של התוכנה וודא שגם אותות התזוזה של piezo וגם אותות הסטייה של cantilever נעים למעלה בו-זמנית (איור S1C).
- אם יש אי התאמה בזמן, הבדיקה אינה במגע מלא עם הזכוכית. עבור במורד הגשושית בשלבים של 1 מיקרומטר עד שקו הבסיס של האות הקנטילברי ישתנה (ראה שלב 7) וחזור על שלב 9.
- אם אות הקנטילבר אינו משתנה כלל במהלך שלב הכיול , אז הגשושית רחוקה מפני השטח. הגדל את סף המגע באופן איטרטיבי (ראה שלב 8) עד שהמשטח יימצא כראוי וחזור על הכיול מההתחלה החל מסריקת אורך הגל.
- לאחר השלמת הכיול, בדוק את גורמי הכיול הישנים והחדשים בחלון המוקפץ המוצג. אם מקדם הכיול החדש נמצא בטווח הנכון, לחץ על השתמש בגורם חדש. אם הכיול נכשל, והגורם החדש הוא NaN או שאינו בטווח הצפוי, ראה דיון (פתרון בעיות של השיטה) לפתרון.
הערה: הגורם החדש צריך להיות נמוך פי ~n מזה שסופק על תיבת הבדיקה אם הכיול בוצע בתווך נוזלי עם מקדם שבירה n (n = 1.33 עבור מים ). אם הכיול בוצע באוויר, אז גורמי הכיול החדשים והישנים צריכים להיות שווים בערך. - בדוק אם מעגל הדמודולציה כויל כראוי באופן הבא. נווט אל הכרטיסייה דמודולציה בשולחן העבודה של האינטרפרומטר. הקש בעדינות על השולחן האופטי או על הננו-אינדנטר כדי לגרום למספיק רעש. עיגול לבן המורכב מנקודות נתונים בדידות אמור לכסות בקירוב את העיגול האדום (איור S1D).
- אם העיגול הלבן אינו חופף לעיגול האדום, או אם מופיעה אזהרה בתצוגת האינטרפרומטר, עיגול הדמודולציה זקוק לכיול מחדש. ניתן לעשות זאת בשתי דרכים כמתואר להלן.
- הקש ברציפות על גופו של הננו-אינדנטר כדי לגרום למעגל שלם אחד של רעש ולחץ על לחצן הכיול באינטרפרומטר.
- הזן מגע עם מצע הזכוכית ולחץ על כיול מתפריט אתחול החלון הראשי של התוכנה. אל תשמור את מקדם הכיול. בשלב זה, בדוק שוב וודא שהעיגול הלבן חופף לעיגול האדום.
הערה: אם האות לא רק נעקר מעט ממעגל הדמודולציה אלא נעשה קטן מאוד או אינו נראה כלל, פירוש הדבר שהקנטילבר דבוק לסיב האופטי. בצע את העצה לפתרון בעיות עבור בעיה זו (ראה דיון, פתרון בעיות של השיטה) וחזור על שלבים 13.1 או 13.2. ברגע שהקנטילבר יחזור למקומו האופקי (איור 3A), האות יתאושש למעגל הדמודולציה.
- אמת את הכיול על-ידי ביצוע כניסה על מצע הזכוכית מיד לאחר הכיול כמתואר להלן.
- טען או צור קובץ ניסוי על-ידי לחיצה על קביעת תצורה של ניסוי והוסף שלב חיפוש משטח ושלב כניסה . לשלב ההזחה, השתמש בהגדרות ברירת המחדל של מצב התזוזה ושנה את התזוזה המרבית למרחק הכיול (3,000 ננומטר) כדי להזיז את הבדיקה כנגד המצע הנוקשה.
- לחץ על הפעל ניסוי ובדוק את מעגל הדמודולציה בחלון האינטרפרומטר. בדוק את האות הלבן וודא שהוא נמצא מעל העיגול האדום במהלך הכניסה.
- בדוק את התוצאות בחלון הראשי של התוכנה בגרף נתוני זמן , וודא שהתזוזה של הפיאזו (הקו הכחול) שווה לסטייה של ה-cantilever (הקו הירוק) מכיוון שהכניסה מתחילה במגע ולא צפוי עיוות מהותי. אם האותות אינם מקבילים, ראה דיון (פתרון בעיות של השיטה).
- שנה את הנתיב המקומי בתפריט הכיול על-ידי הגדרת נתיב שמירת הכיול לספרייה מתאימה.
- כאשר הגשושית כוילה בהצלחה, הזיזו את הפיאזו ב-500 מיקרומטר.
4. מדידת מודולוס החומרים הרכים של הצעירים
- ננו-כניסה של הידרוג'לים
- טען את צלחת הפטרי המכילה את הדגימה(ות) על בימת המיקרוסקופ והעבר ידנית את הגשושית של הננו-אינדנטר למיקום x-y רצוי מעל הדגימה.
- החלק ידנית את הבדיקה בתמיסה, תוך הקפדה להשאיר 1-2 מ"מ בין הגשושית לבין פני השטח של הדגימה בשלב זה. המתן 5 דקות עד שהגשושית תתאזן במדיום.
- מקד את מישור z של המיקרוסקופ האופטי כך שהגשושית נראית בבירור.
- בצע כניסה יחידה כדי לכוונן את הפרמטרים הניסיוניים כמתואר להלן.
- הגדר ניסוי חדש בחלון הראשי של התוכנה. לחץ על הגדר ניסוי, אשר יפתח חלון חדש. הוסף שלב חיפוש משטח . ניתן לשנות את כל הפרמטרים של שלב Find Surface בתפריט אפשרויות של התוכנה במידת הצורך.
הערה: משטח החיפוש ינמיך את הגשושית עד למציאת המשטח, ואז הוא יחזיר את הגשושית למרחק שהוגדר על-ידי Z מעל פני השטח (μm), מעל פני השטח של הדגימה. אם הדגימה שנבחרה נוקשה מדי עבור הדגימה או שהדגימה דביקה, לאחר השלב סביר להניח שהבדיקה עדיין תהיה במגע עם הדגימה, מה שיגרום לעקומה ללא קו בסיס (איור 4C). כדי לפתור בעיה זו, הגדל את Z מעל פני השטח (μm). - הוסף שלב כניסה . בחר את פרופיל הכרטיסייה ולחץ על בקרת תזוזה. השאר את פרופיל הכניסה המוגדר כברירת מחדל.
- לחץ על הפעל ניסוי בחלון התוכנה הראשי. פעולה זו תמצא את פני השטח ותבצע כניסה יחידה. אם הכניסה היחידה אינה נראית כצפוי, התאם את הפרמטרים הניסיוניים כמתואר באיור 4 ובדיון (פתרון בעיות של השיטה).
- הגדר ניסוי חדש בחלון הראשי של התוכנה. לחץ על הגדר ניסוי, אשר יפתח חלון חדש. הוסף שלב חיפוש משטח . ניתן לשנות את כל הפרמטרים של שלב Find Surface בתפריט אפשרויות של התוכנה במידת הצורך.
- לאחר שהכניסה תיראה כרצונה, הגדר את סריקת המטריצה כך שאזור מספיק של המדגם יוסט פנימה. לחץ על הגדר ניסוי, הוסף שלב Find Surface עם הפרמטרים הניסיוניים שנקבעו בעבר והוסף שלב סריקת מטריצה .
- עבור הידרוג'לים שטוחים, הגדר סריקת מטריצה המכילה 50-100 נקודות (כלומר, 5 x 10 או 10 x 10 ב- x ו- y) במרווחים של 10-100 מיקרומטר (כלומר, dx = dy = 10-100 מיקרומטר). לחץ על השתמש במיקום שלב כדי להתחיל את סריקת המטריצה ממיקום השלב הנוכחי. ודא שהתיבה ' חיפוש אוטומטי של משטח' מסומנת כדי למצוא את המשטח בכל כניסה באמצעות הפרמטרים הניסיוניים שהוגדרו.
- כדי למנוע דגימת יתר, הגדר את גודל הצעד לפחות פי שניים מרדיוס המגע (
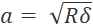 , כאשר δ הוא עומק הכניסה).
, כאשר δ הוא עומק הכניסה). - הגדר את פרופיל סריקת המטריצה בבקרת תזוזה. ודא שהפרופיל אינו מפר את ההנחות של מודל הרץ (ראה דיון, שלבים קריטיים בפרוטוקול).
- השאר את מספר המקטעים על 5, שהוא ערך ברירת המחדל, והשתמש בפרופיל התזוזה המוגדר כברירת מחדל. במידת הצורך, שנה את פרופיל התזוזה במונחים של תזוזה וזמן מרביים עבור כל קטע משופע, אשר ישפיע על עומק הכניסה המרבי ועל קצב המתח, בהתאמה. אין לחרוג מקצבי המתח >-10 מיקרומטר לשנייה (ראו דיון, מגבלות השיטה).
- הזינו ערך למהירות הגישה, שקובע את מהירות העקירה של הבדיקה לכיוון הדגימה לפני המגע. התאם את מהירות הנסיגה למהירות הגישה (ראה הערה להלן).
הערה: עבור מנופים רכים וסביבות רועשות, מומלצת מהירות גישה של 1,000-2,000 ננומטר לשנייה. עבור מנופים נוקשים יותר וסביבות מבוקרות, ניתן להגדיל זאת. - שמור את הניסוי שהוגדר בנתיב הניסוי הרצוי ובחר ספריה שבה הנתונים יישמרו בנתיב השמירה, בכרטיסיה כללי בחלון קביעת תצורה של ניסוי. לחץ על הפעל ניסוי.
- כדי למנוע דגימת יתר, הגדר את גודל הצעד לפחות פי שניים מרדיוס המגע (
- לאחר השלמת סריקת המטריצה, הרם את הגשושית ב-200-500 מיקרומטר והעבר את הגשושית לאזור אחר של הדגימה רחוק מספיק מהאזור הראשון.
- חזור על הניסוי לפחות פעמיים כדי שיירכשו מספיק נתונים על כל דגימה (כלומר, לפחות שתי סריקות מטריצה לכל דגימה, המכילות 50-100 עקומות כל אחת).
- ננו-אינדנציה של תאים
- טען את הדגימה על המיקרוסקופ כמתואר לעיל.
- עבור כניסה חד-תאית, מקד את מישור z כך שגם התאים וגם הבדיקה יהיו גלויים בהגדלה של 20x או 40x, בהתאם לגודל התא ולהתפשטותו.
- הזז את הבדיקה מעל התא כדי להסיט אותה פנימה.
- הגדר ניסוי חדש בחלון הראשי של התוכנה. לחץ על הגדר ניסוי, אשר יפתח חלון חדש. הוסף שלב חיפוש משטח וכניסה עם פרמטרי ברירת המחדל במצב הזחה.
- לחץ על הפעל ניסוי, אשר ימצא את פני השטח ויבצע כניסה אחת. בדוק אם הכניסה בוצעה בהצלחה. אם העקומה אינה נראית כצפוי, התאם את הפרמטרים הניסיוניים (ראה איור 4 ודיון, פתרון בעיות של השיטה).
- אם הכניסה הצליחה, הוסף סריקת מטריצה לניסוי. בצע את השלבים שניתנו לניסויים בננו-אינסטנציה של הידרוג'לים; להגדיר את סריקת המטריצה כך שגודל הצעד יאפשר להסיט פנימה שטח קטן של התא; 25 נקודות במרווחים של 0.5-5 מיקרומטר עבור תאי HEK293T.
- בהתאם לגודל התא, התאם את סריקת המטריצה כדי להבטיח שהקצה לא ייכנס מחוץ לגבול התא, כלומר, ביצוע גיאומטריית מפה שונה או בדיקה של פחות נקודות.
- לחץ על הפעל ניסוי והמתן עד להשלמתו.
- לאחר השלמת סריקת המטריצה, הרם את הגשושית מחוץ למגע (50 מיקרומטר במישור z ).
- העבר את הבדיקה מעל תא חדש וחזור על התהליך (ראה דיון, שלבים קריטיים בפרוטוקול).
- ניקוי הבדיקה וכיבוי המכשיר
- בצע את השלבים המפורטים בפרוטוקול המשלים כדי לנקות את הבדיקה ולכבות את התקן הננו-כניסה.
5. ניתוח נתונים
- הורדה והתקנה של התוכנה
- בצע את השלבים המפורטים בפרוטוקול המשלים כדי להוריד ולהתקין את התוכנה לניתוח נתונים28,29.
- סינון עקומות F-z והפקת ערכת נתונים מנוקים בפורמט JSON
- הפעל prepare.py משורת הפקודה במחשב המעבדה כמתואר בשלבים 2 עד 3.
- אם אתה משתמש במחשב Windows, החזק את מקש shift תוך כדי לחיצה ימנית על התיקייה NanoPrepare ולחץ על פתח חלון PowerShell כאן. הקלד את הפקודה python prepare.py ולחץ על מקש Enter . ממשק משתמש גרפי יופיע על המסך (איור S2).
- אם אתה משתמש במחשב MacOS, לחץ באמצעות לחצן העכבר הימני על התיקייה NanoPrepare ולחץ על מסוף חדש בתיקייה. הקלד את הפקודה python3 prepare.py ולחץ על מקש Enter , שיפעיל את ממשק המשתמש הגרפי (איור S2).
- בחר את תבנית הנתונים O11NEW מהרשימה הנפתחת. אם הנתונים אינם נטענים כראוי, הפעל מחדש את ממשק המשתמש הגרפי ובחר O11OLD.
הערה: התבנית O11NEW פועלת עבור נתונים המתקבלים באמצעות התקני ננו-אינדנטנציה עם חישת סיבים אופטיים עם גרסת תוכנה 3.4.1. פורמט זה יעבוד גם עבור גרסאות תוכנה קודמות, לפחות אלה השייכות לננו-אינדנטנטים שהותקנו בשנים 2019-2020. - לחץ על טען תיקייה. בחר תיקייה המכילה את הנתונים לניתוח - סריקת מטריצה יחידה או סריקות מטריצה מרובות. הגרף העליון (עקומות גולמיות) יאוכלס בערכת הנתונים שהועלתה. כדי לדמיין עקומה מסוימת, לחץ עליה. פעולה זו תסמן אותו בירוק ותציג אותו בגרף התחתון (עקומה נוכחית).
- נקה את ערכת הנתונים באמצעות הכרטיסיות הקיימות בחלק הימני של ממשק המשתמש הגרפי כמפורט להלן.
- השתמש בלחצן Segment כדי לבחור את המקטע הנכון לניתוח, שהוא המקטע הקדמי של עקומות F-z . המספר הספציפי תלוי במספר המקטעים שנבחרו בתוכנת הננו-אינדנטנציה בעת ביצוע ניסויים.
- השתמש בלחצן חתוך 50 ננומטר כדי לחתוך את העקומות ב- 50 ננומטר בקצה השמאלי (אם L מסומן), מימין (אם R מסומן) או משני הצדדים (אם גם R וגם L מסומנת). לחץ על לחצן זה מספר פעמים כדי לחתוך כמה שנדרש. השתמש באפשרות זו כדי להסיר לכלוכים הנמצאים בהתחלה/בסוף של עקומות F-z .
- בדוק את הכרטיסייה Cantilever עבור קבוע הקפיץ, גיאומטריית הקצה ורדיוס הקצה. בדוק את הכרטיסיה כדי לוודא שהמטה-נתונים נקראו כהלכה.
- השתמש בכרטיסיה סינון כדי להגדיר סף כוח שיבטל את כל העקומות שלא הגיעו לכוח הנתון. עקומות שהושלכו יסומנו באדום.
- השתמש בלחצן דו-מצבי ידני כדי להסיר באופן ידני עקומות שלא הושגו כהלכה. הסר עקומות על-ידי לחיצה על העקומה הספציפית ובחירה באפשרות OUT, אשר תסמן את העקומה באדום.
- לחץ על שמור JSON. הזן שם מתאים לערכת הנתונים המנוקה, שהיא קובץ JSON יחיד. שלח את קובץ JSON למחשב שבו הותקנה תוכנת NanoAnalysis.
6. ניתוח נתונים פורמלי
- הפעל את קובץ nano.py משורת הפקודה על ידי ניווט לתיקיית NanoAnalysis והפעלת מסוף כפי שהוסבר קודם לכן. הקלד את הפקודה python nano.py או python3 nano.py (בהתאם למערכת ההפעלה) והקש על מקש Enter . ממשק משתמש גרפי יופיע על המסך (איור S3).
- בפינה השמאלית העליונה של ממשק המשתמש הגרפי, לחץ על טען ניסוי ובחר את קובץ JSON. פעולה זו תאכלס את רשימת הקבצים ואת הגרף Raw Curves המציג את ערכת הנתונים במונחים של עקומות F-z. שני הצירים F ו- z מוצגים ביחס לקואורדינטות CP, המחושבות ברקע בעת טעינת ערכת הנתונים (ראה הערה הבאה). בתיבה נתונים סטטיסטיים, סמן את הערכים של שלושת הפרמטרים: Nהופעל, N נכשל ו- Nלא נכלל.
הערה: Nמופעל מייצג את מספר העקומות שינותחו בניתוח ספקטרום הרץ/אלסטיות הבא ויופיעו בשחור בגרף עקומות גולמיות . Nנכשל מייצג את מספר העקומות שבהן לא ניתן היה למצוא CP אמין ולהופיע בכחול בגרף. עקומות אלה יושלכו באופן אוטומטי בניתוח הבא. עם פתיחת התוכנה, עקומות מסוימות עשויות להיות מועברות באופן אוטומטי לערכה שנכשלה. הסיבה לכך היא שה- CP מחושב עם פתיחת התוכנה עם אלגוריתם סף ברירת המחדל (ראה להלן). Nלא נכלל מייצג את העקומות שנבחרו באופן ידני כדי שלא ייכללו בניתוח ויופיעו באדום בגרף (ראה להלן). - בדוק אם מספר העקומות שנכשלו, לא נכללו והופעלו הוא סביר. בדוק את הגרף עקומות גולמיות כדי להציג את העקומות באופן חזותי.
- כדי לדמיין עקומה מסוימת בפירוט רב יותר, לחץ עליה. פעולה זו תסמן אותו בירוק ותציג אותו בגרף העקומה הנוכחית . לאחר שנבחרה עקומה בודדת, הפרמטרים R ו - k (שחייבים להיות זהים עבור כל העקומות) יאוכלסו בתיבה Stats של ממשק המשתמש הגרפי.
- שנה את המצב של עקומה נתונה באמצעות התיבה הדו-מצבי . לחץ על העקומה הספציפית שברצונך לשנות את הסטטוס שלה ולאחר מכן לחץ על הופעל, נכשל או לא נכלל. הספירה בתיבה נתונים סטטיסטיים מתעדכנת באופן אוטומטי.
הערה: כדי לשנות את התצוגה של ערכת הנתונים בתרשים עקומות גולמיות, השתמש בתיבה תצוגה. לחץ על הכל כדי להציג את כל העקומות (כלומר, מופעלות, נכשלות ואינן נכללות בצבעים המתאימים). לחץ על נכשל כדי להציג את העקומות המופעלות והכושלות ולחץ על מופעל כדי להציג רק את העקומות שהופעלו. כדי לאפס את המצב של כל העקומות בין מופעל ללא נכלל, לחץ על מופעל או לא נכלל בתיבה איפוס. - לאחר ניקוי נוסף של מערך הנתונים, עקוב אחר צינור ניתוח הנתונים המתואר להלן.
- סנן את כל הרעש הקיים בעקומות באמצעות המסננים המיושמים בממשק המשתמש הגרפי (GUI - תיבת הסינון), כלומר, מסנן מותאם אישית הנקרא מסנן בולטות, מסנן Savitzky Golay30,31 (SAVGOL) ומסנן החלקה המבוסס על חישוב החציון של הנתונים בחלון נתון (מסנן חציוני). ראה דיון (שלבים קריטיים בפרוטוקול) לקבלת פרטים על מסננים.
- בדוק את העקומות המסוננות בתרשים העקומה הנוכחית . העקומה המסוננת מוצגת בשחור ואילו הגרסה הלא מסוננת של העקומה מוצגת בירוק.
הערה: מומלץ לסנן את הנתונים מעט ככל האפשר כדי לשמר תכונות של האות המקורי. סינון יתר עשוי להחליק את כל ההבדלים הקיימים בנתונים. עבודה עם מסנן הבולטות המופעל מספיקה לניתוח הרץ של נתוני ננו-אינדנציה. אם הנתונים רועשים במיוחד, ניתן להחיל בנוסף מסנני SAVGOL או חציוניים. - בחר אלגוריתם כדי למצוא את CP. בתיבה נקודת מגע, בחר אחת מסדרה של הליכים מספריים שיושמו בתוכנה, כלומר, טוב ההתאמה (GoF)32, יחס השונות (RoV)32, נגזרת שנייה 33 או סף 33. ראה דיון, שלבים קריטיים בפרוטוקול לקבלת פרטים על האלגוריתמים.
הערה: ה-CP הוא הנקודה שבה הגשושית באה במגע עם החומר וצריכה להיות מזוהה על מנת להמיר נתוני F-z לנתוני F-δ (עבור חומרים רכים, δ הוא סופי וצריך לחשב אותו). האלגוריתם שנבחר יוחל על כל העקומות הפעילות של ערכת הנתונים, ועקומות שבהן האלגוריתם אינו מצליח לאתר את ה-CP בחוזקה יועברו לערכה שנכשלה. - התאם את הפרמטרים של האלגוריתם כך שיתאימו לערכת הנתונים שלך כך שה- CP ימוקם כראוי כמפורט בדיון , שלבים קריטיים בפרוטוקול. כדי לראות היכן נמצא ה- CP בעקומה אחת, בחר את העקומה על ידי לחיצה עליה ולחץ על בדוק. בדוק את החלון המוקפץ שמופיע כדי לזהות היכן נמצא ה- CP.
- בדוק אם לקו האדום שמופיע, שהוא הפרמטר שהאלגוריתם חישב באזור העניין שנבחר, יש ערך מקסימלי או מינימלי המתאים למיקום ה- CP (לדוגמה, עבור ה- GoF, הפרמטר הוא R2). חזור על תהליך זה עבור כל העקומות במידת הצורך.
הערה: הצירים של החלון הנפתח הם בקואורדינטות מוחלטות כך שניתן להציג את מיקום ה- CP. לעומת זאת, הצירים של גרף העקומות הגולמיות והעקומה הנוכחית מוצגים ביחס ל- CP, כלומר, מיקום ה- CP הוא (0,0). - לחץ על ניתוח הרץ. זה יפיק שלושה גרפים המתוארים להלן.
- בדוק עקומות F-δ בודדות בערכת הנתונים יחד עם ההתאמה הממוצעת של הרץ (קו מקווקו אדום). התאם את הכניסה ב- nm עד שמודל הרץ מותקן בתיבה תוצאות תחת כניסה מרבית (ננומטר). הגדר אותו למקסימום של ~10% מ- R כדי שמודל הרץ יהיה תקף (ראה דיון, שלבים קריטיים בפרוטוקול).
- בדוק את עקומת ה- F-δ הממוצעת באמצעות רצועת שגיאה המציגה סטיית תקן אחת (SD) יחד עם התאמת הרץ הממוצעת (קו מקווקו אדום). הצג באופן חזותי את ההתאמה הממוצעת של הרץ בגרף עקומות גולמיות לעיון ואת התאמת הרץ לכל עקומה בעקומה הנוכחית.
- בדוק את חלקת הפיזור של E שמקורה בהתאמת מודל הרץ לכל עקומה בנפרד.
- לחצו על שם הקובץ, עקומת F-z , עקומת F-δ או על נקודה במתווה הפיזור כדי להדגיש את העקומה בכל עלילה. אם נראה שנקודת נתונים בהתוויית הפיזור נמצאת מחוץ להתפלגות הנתונים, לחץ עליה ובדוק את העקומה שאליה היא שייכת. ודא שה- CP אותר כראוי על-ידי לחיצה על לחצן בדוק . אל תכלול את העקומה מהניתוח במידת הצורך.
- בדוק את תיבת התוצאות עבור הממוצע המחושב E וה- SD שלו (Eγ ± σ) וודא שהם סבירים לניסוי הנתון.
- בתיבה שמור , לחץ על הרץ. בחלון המוקפץ, הזן שם קובץ וספריה. לאחר שתסיים, לחץ על שמור. ייווצר קובץ .tsv. פתח את קובץ ה- .tsv בכל תוכנה נוספת של העדפה והשתמש בערכים לניתוח סטטיסטי והתוויה נוספת.
הערה: הקובץ מכיל את האות E המתקבלת מכל עקומה ואת הממוצע E וה-SD שלה. בנוסף, הקובץ מכיל מטא-נתונים המשויכים לניתוח, כולל מספר העקומות שנותחו, R, k וההזחה המרבית המשמשת למודל הרץ. - שלב זה הוא אופציונלי. לחץ על F-Ind ממוצע כדי לייצא את הכוח הממוצע ואת הכניסה הממוצעת, יחד עם SD אחד בכוח.
- לקבלת נתוני ננו-אינדנטנציה של תאים, לחץ על ניתוח ספקטרום האלסטיות (ראה תוצאות מייצגות ודיון). בדוק את שתי החלקות המיוצרות, כלומר, E כפונקציה של עומק הכניסה (E(δ)) עבור כל עקומה, ואת E(δ) הממוצע עם רצועת שגיאה המציגה SD אחד (קו אדום מוצק ואזור מוצלל) המותאם על ידי מודל (קו מקווקו שחור), המאפשר להעריך את מודולוס יאנג של קליפת האקטין של התא, מודולוס יאנג של התא, ועובי קליפת האטין. בנוסף, בדוק את הממוצע E(δ) בגרף העליון באדום.
- ודא שהתיבה אינטרפולציה מסומנת, מה שמבטיח שהנגזרת הדרושה לביצוע ניתוח ספקטרום האלסטיות מחושבת על האות האינטרפולטיבי (ראה תוצאות מייצגות).
- בדוק את תיבת התוצאות, המדווחת על מודולוס יאנג של קליפת המוח (E 0 ± σ), על המודולוס של יאנג בתפזורת התא (Eb ± σ) ועל עובי קליפת המוח (d0 ± σ).
הערה: ספקטרום האלסטיות הממוצע עשוי להיראות רועש בהתחלה, עם תנודות סינוסואידליות בולטות. כתוצאה מכך, ייתכן שמשוואה (3) לא תותקן כראוי. אם זה המקרה, הגדלה איטרטיבית של אורך החלון של מסנן SAVGOL החלקה34 פותרת בעיה זו. - לאחר סיום הניתוח, לחץ על ES בתיבה שמור . פעולה זו תייצא קובץ .tsv בספרייה שצוינה, המכיל את האלסטיות הממוצעת כפונקציה של עומק הכניסה הממוצע ורדיוס המגע, המטא-נתונים המשויכים לניסוי (ראה לעיל) ופרמטרי המודל המשוערים שהוסברו לעיל. לבסוף, מדווחים גם על האלסטיות הממוצעת המתעלמת מהתלות δ וב-SD שלה.
- סגור את התוכנה והזן את התוצאות שנשמרו בכל תוכנה אחרת של העדפה כדי להתוות עוד יותר את הנתונים ולבצע ניתוח סטטיסטי.
- שלב זה הוא אופציונלי: ייצוא גרפים מממשק המשתמש הגרפי (GUI) על-ידי לחיצה ימנית על הגרף ובחירה באפשרות יצא. ייצא את הגרף ב- .svg, כך שפרמטרים כגון גופן, גודל גופן, סגנון קו וכו '. ניתן לערוך בתוכנה אחרת לפי בחירה.
הערה: ניתן לתכנת אלגוריתמים ומסננים מותאמים אישית של CP ולהוסיף אותם לאלה הקיימים כבר. ראה הערה משלימה 1 לפרטים.
תוצאות
בעקבות הפרוטוקול, מתקבלת קבוצה של עקומות F-z. מערך הנתונים יכיל ככל הנראה עקומות טובות, ועקומות שיש להשליך לפני שתמשיך בניתוח. באופן כללי, יש למחוק עקומות אם צורתן שונה מזו המוצגת באיור 4A. איור 5AI מראה מערך נתונים של ~100 עקומות המתקבלות על הידרוג'ל PAAm רך של ...
Discussion
פרוטוקול זה מראה כיצד להשיג בחוזקה נתוני ננו-אינדנטנציה של ספקטרוסקופיית כוח באמצעות ננו-אינדנטר בעל ראש ברזל זמין מסחרית הן על הידרוג'לים והן על תאים בודדים. בנוסף, ניתנות הוראות לשימוש בתוכנת קוד פתוח המתוכנתת בפייתון הכוללת זרימת עבודה מדויקת לניתוח נתוני ננו-אינדנציה.
...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
GC ו-MAGO מודים לכל חברי ה-CeMi. MSS מאשרת תמיכה באמצעות מענק תוכנית EPSRC (EP/P001114/1).
GC: תוכנה (תרומה לפיתוח תוכנה ואלגוריתמים), ניתוח פורמלי (ניתוח נתוני ננו-אינדנציה), ולידציה, חקירה (ניסויי ננו-אינדנציה בג'לים פוליאקרילאמידים), אוצרות נתונים, כתיבה (טיוטה מקורית, סקירה ועריכה), ויזואליזציה (איורים וגרפים). MAGO: חקירה (הכנת ג'לים ודגימות תאים, ניסויי ננו-אינדנטציה על תאים), כתיבה (טיוטה מקורית, סקירה ועריכה), הדמיה (איורים וגרפים). NA: אימות, כתיבה (סקירה ועריכה). IL: תוכנה (תרומה לפיתוח תוכנה ואלגוריתמים), ולידציה, כתיבה (סקירה ועריכה); MV: המשגה, תוכנה (תכנון ופיתוח של תוכנות ואלגוריתמים מקוריים), ולידציה, משאבים, כתיבה (טיוטה מקורית, סקירה ועריכה), פיקוח, ניהול פרויקטים, מימון רכישת MSS: משאבים, כתיבה (סקירה ועריכה), פיקוח, ניהול פרויקטים, רכישת מימון. כל המחברים קראו ואישרו את כתב היד הסופי.
Materials
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | VWR | 631-1577P | |
| 35 mm cell treated culture dishes | Greiner CELLSTAR | 627160 | |
| Acrylamide | Sigma-Aldrich | A4058 | |
| Acrylsilane | Alfa Aesar | L16400 | |
| Ammonium Persulfate | Merk | 7727-54-0 | |
| Bisacrylamide | Merk | 110-26-9 | |
| Chiaro nanoindenter | Optics 11 Life | no catologue number | |
| Ethanol | general | ||
| Fetal bovine serum | Gibco | 16140071 | |
| High glucose DMEM | Gibco | 11995065 | |
| Isopropanol | general | ||
| Kimwipe | Kimberly Clark | 21905-026 | |
| Microscope glass slides | VWR | 631-1550P | |
| MilliQ system | Merk Millipore | ZR0Q008WW | |
| OP1550 Interferometer | Optics11 Life | no catalogue number | |
| Optics 11 Life probe (k = 0.02-0.005 N/m, R = 3-3.5 um) | Optics 11 Life | no catologue number | |
| Optics 11 Life probe (k = 0.46-0.5 N/m, R = 50-55 um) | Optics 11 Life | no catologue number | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| RainX rain repellent | RainX | 26012 | |
| Standard petri dishes (90 mm) | Thermo Scientific | 101RTIRR | |
| Tetramethylethylenediamine | Sigma-Aldrich | 110-18-9 | |
| Vaccum dessicator | Thermo Scientific | 531-0250 | |
| Software | |||
| Data acquisition software (v 3.4.1) | Optics 11 Life | ||
| GitHub Desktop (Optional) | Microsoft | ||
| Python 3 | Python Software Foundation | ||
| Visual Studio Code (Optional) | Microsoft |
References
- Discher, D. E., Janmey, P. Y. W. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Roca-Cusachs, P., Conte, V., Trepat, X. Quantifying forces in cell biology. Nature Cell Biology. 19 (7), 742-751 (2017).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature. Reviews. Materials. 5, 351-370 (2020).
- Moeendarbary, E., Harris, A. R. Cell mechanics: Principles, practices, and prospects. Wiley Interdisciplinary. Reviews. Systems. Biology and Medicine. 6 (5), 371-388 (2014).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nature Reviews Cancer. 9 (2), 108-122 (2009).
- Kubánková, M., et al. Physical phenotype of blood cells is altered in COVID-19. Biophysical Journal. 120 (14), 2838-2847 (2021).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- Ciccone, G., et al. What caging force cells feel in 3D hydrogels: A rheological perspective. Advanced Healthcare Materials. 9 (17), 2000517 (2020).
- Wu, P. H., et al. A comparison of methods to assess cell mechanical properties. Nature Methods. 15 (7), 491-498 (2018).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of young's modulus for soft biological tissues. Tissue Engineering B Reviews. 17 (3), 155-164 (2011).
- Humphrey, J. D., Delange, S. L. . An Introduction to Biomechanics Solids and Fluids, Analysis and Design. , 271-371 (2004).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: an emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1, 41-57 (2019).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Gavara, N. A beginner's guide to atomic force microscopy probing for cell mechanics. Microscopy Research and Technique. 80 (1), 75-84 (2017).
- Whitehead, A. J., Kirkland, N. J., Engler, A. J. Atomic force microscopy for live-cell and hydrogel measurement. Methods in Molecular Biology. 2299, 217-226 (2021).
- Chavan, D., et al. Ferrule-top nanoindenter: An optomechanical fiber sensor for nanoindentation. The Review of Scientific Instruments. 83 (11), 115110 (2012).
- Van Hoorn, H., Kurniawan, N. A., Koenderink Ac, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12 (12), 3066-3073 (2016).
- Baldini, F., et al. Biomechanics of cultured hepatic cells during different steatogenic hits. Journal of the Mechanical Behavior of Biomedical Materials. 97, 296-305 (2019).
- Emig, R., et al. Piezo1 channels contribute to the regulation of human atrial fibroblast mechanical properties and matrix stiffness sensing. Cells. 10 (3), 663 (2021).
- Dobre, O., et al. A hydrogel platform that incorporates laminin isoforms for efficient presentation of growth factors - Neural growth and osteogenesis. Advanced Functional Materials. 31 (21), 2010225 (2021).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Scientific Reports. 8 (1), 12517 (2018).
- Wu, G., Gotthardt, M., Gollasch, M. Assessment of nanoindentation in stiffness measurement of soft biomaterials: kidney, liver, spleen and uterus. Scientific Reports. 10 (1), 18784 (2020).
- Lüchtefeld, I., et al. Elasticity spectra as a tool to investigate actin cortex mechanics. Journal of Nanobiotechnology. 18 (1), 147 (2020).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Blumlein, A., Williams, N., McManus, J. J. The mechanical properties of individual cell spheroids. Scientific Reports. 7 (1), 7346 (2017).
- Mirsandi, H., et al. Influence of wetting conditions on bubble formation from a submerged orifice. Experiments in Fluids. 61, 83 (2020).
- Vassalli, M., Ciccone, G. . CellMechLab/NanoPrepare: v0.1.1. Zendo. , (2021).
- Vassalli, M., Ciccone, G., Lüchtefeld, I. CellMechLab/nanoindentation: v1.0.0. Zendo. , (2021).
- Savitzky, A., Golay, M. J. E. Smoothing and differentiation of data by simplified least squares procedures. Analytical Chemistry. 36 (8), 1627-1639 (1964).
- Schafer, R. W. What is a savitzky-golay filter. IEEE Signal Processing Magazine. 28 (4), 111-117 (2011).
- Gavara, N. Combined strategies for optimal detection of the contact point in AFM force-indentation curves obtained on thin samples and adherent cells. Scientific Reports. 6, 21267 (2016).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2007).
- Virtanen, P., et al. SciPy 1.0: fundamental algorithms for scientific computing in Python. Nature Methods. 17 (3), 261-272 (2020).
- Tse, J. R., Engler, A. J. Preparation of hydrogel substrates with tunable mechanical properties. Current Protocols in Cell Biology. , (2010).
- Pharr, G. M., Oliver, W. C., Brotzen, F. R. On the generality of the relationship among contact stiffness, contact area, and elastic modulus during indentation. Journal of Materials Research. 7 (3), 613-617 (1992).
- Kumar, R., Saha, S., Sinha, B. Cell spread area and traction forces determine myosin-II-based cortex thickness regulation. Biochimica et Biophysica Acta - Molecular Cell Research. 1866 (12), 118516 (2019).
- Kunda, P., Pelling, A. E., Liu, T., Baum, B. Moesin controls cortical rigidity, cell rounding, and spindle morphogenesis during mitosis. Current Biology: CB. 18 (2), 91-101 (2008).
- Allen, M., Poggiali, D., Whitaker, K., Marshall, T. R., Kievit, R. A. Raincloud plots: a multi-platform tool for robust data visualization. Wellcome Open Research. 4, 63 (2019).
- Clark, A. G., Paluch, E. Mechanics and regulation of cell shape during the cell cycle. Results and Problems in Cell Differentiation. 53, 31-73 (2011).
- Langan, T. J., Rodgers, K. R., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 1524, 97-105 (2017).
- Hodgkinson, T., et al. The use of nanovibration to discover specific and potent bioactive metabolites that stimulate osteogenic differentiation in mesenchymal stem cells. Science Advances. 7 (9), 7921 (2021).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Advanced Materials (Deerfield Beach, Fla). 22 (31), 3484-3494 (2010).
- Loessner, D., et al. Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nature Protocols. 11 (4), 727-746 (2016).
- Yue, K., et al. Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- Sarrigiannidis, S. O., et al. A tough act to follow: collagen hydrogel modifications to improve mechanical and growth factor loading capabilities. Materials Today. Bio. 10, 100098 (2021).
- Karoutas, A., et al. The NSL complex maintains nuclear architecture stability via lamin A/C acetylation. Nature Cell Biology. 21 (10), 1248-1260 (2019).
- Ryu, H., et al. Transparent, compliant 3D mesostructures for precise evaluation of mechanical characteristics of organoids. Advanced Materials (Deerfield Beach, Fla). 33 (25), 2100026 (2021).
- Carvalho, D. T. O., Feijão, T., Neves, M. I., Da Silva, R. M. P., Barrias, C. C. Directed self-assembly of spheroids into modular vascular beds for engineering large tissue constructs Biofabrication Directed self-assembly of spheroids into modular vascular beds for engineering large tissue constructs. Biofabrication. 13 (3), 035008 (2021).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Cantini, M., Donnelly, H., Dalby, M. J., Salmeron-Sanchez, M. The plot thickens: The emerging role of matrix viscosity in cell mechanotransduction. Advanced Healthcare Materials. 9 (8), 1901259 (2020).
- Elosegui-Artola, A. The extracellular matrix viscoelasticity as a regulator of cell and tissue dynamics. Current Opinion in Cell Biology. 72, 10-18 (2021).
- Chaudhuri, O. Viscoelastic hydrogels for 3D cell culture. Biomaterials Science. 5 (8), 1480-1490 (2017).
- Nguyen, T. D., Gu, Y. Determination of strain-rate-dependent mechanical behavior of living and fixed osteocytes and chondrocytes using atomic force microscopy and inverse finite element analysis. Journal of Biomechanical Engineering. 136 (10), 101004 (2014).
- Mokbel, M., Hosseini, K., Aland, S., Fischer-Friedrich, E. The Poisson Ratio of the Cellular Actin Cortex Is Frequency Dependent. Biophysical Journal. 118 (8), 1968-1976 (2020).
- Javanmardi, Y., Colin-York, H., Szita, N., Fritzsche, M., Moeendarbary, E. Quantifying cell-generated forces: Poisson's ratio matters. Communications Physics. 4, 237 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved