Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yumuşak Madde Nanoindentasyonu için Deneysel ve Veri Analizi İş Akışı
Bu Makalede
Özet
Protokol, hidrojeller ve hücreler de dahil olmak üzere yumuşak malzeme nanogirinti deneyleri için eksiksiz bir iş akışı sunar. İlk olarak, kuvvet spektroskopisi verilerini elde etmek için deneysel adımlar detaylandırılmıştır; Daha sonra, bu tür verilerin analizi, GitHub'dan ücretsiz olarak indirilebilen yeni geliştirilen açık kaynaklı bir Python yazılımı aracılığıyla detaylandırılır.
Özet
Nanogirinti, yumuşak biyomalzemelerin ve hücrelerin yerel mekanik özelliklerini ölçmek için bir mikrometrik kuvvet probunun kullanıldığı bir deneysel teknikler sınıfını ifade eder. Bu yaklaşım, tek hücrelerin boyutuyla (μm) karşılaştırılabilir bir çözünürlüğe sahip yumuşak malzemelerin uygun bir mekanik karakterizasyonunu elde etmek için mekanobiyoloji, biyomalzeme tasarımı ve doku mühendisliği alanlarında merkezi bir rol kazanmıştır. Bu tür deneysel verileri elde etmek için en popüler strateji, atomik kuvvet mikroskobu (AFM) kullanmaktır; Bu cihaz kuvvette (pN'ye kadar) ve uzayda (alt-nm) benzeri görülmemiş bir çözünürlük sunarken, kullanılabilirliği genellikle Young Modülü (E) gibi mekanik özelliklerin integral göstergelerinin rutin ölçümlerini önleyen karmaşıklığı ile sınırlıdır. Optik fiber algılama teknolojisine dayananlar gibi yeni nesil nanoindenterler, son zamanlarda μm uzamsal çözünürlüğe sahip alt-nN kuvvetlerinin uygulanmasına izin verirken, entegrasyon kolaylığı nedeniyle popülerlik kazanmıştır, bu nedenle hidrojellerin ve hücrelerin yerel mekanik özelliklerini araştırmak için uygundur.
Bu protokolde, ticari olarak temin edilebilen bir yüksük üstü optik fiber algılama nanoindenter kullanarak hidrojeller ve hücreler hakkında nanogirinti verilerini elde etmek için deneysel prosedürü detaylandıran adım adım bir kılavuz sunulmaktadır. Bazı adımlar burada kullanılan cihaza özgü olsa da, önerilen protokol, bazı adımların üreticinin yönergelerine göre uyarlanması koşuluyla, diğer nanoindentasyon cihazları için bir rehber olarak alınabilir. Ayrıca, nanogirinti verilerinin analizi için kullanıcı dostu bir grafik kullanıcı arayüzü ile donatılmış yeni bir açık kaynaklı Python yazılımı sunulmaktadır; bu, yanlış edinilmiş eğrilerin taranmasına, veri filtrelemeye, temas noktasının farklı sayısal prosedürlerle hesaplanmasına, E'nin geleneksel hesaplamasına ve özellikle tek hücreli nanogirinti verileri için uygun daha gelişmiş bir analize olanak tanır.
Giriş
Mekaniğin biyolojideki temel rolü günümüzde 1,2 olarak belirlenmiştir. Tüm dokulardan tek hücrelere kadar, mekanik özellikler incelenen biyomateryalin patofizyolojik durumu hakkında bilgi verebilir 3,4. Örneğin, kanserden etkilenen meme dokusu, popüler palpasyon testinin temeli olan bir kavram olan sağlıklı dokudan daha serttir5. Özellikle, son zamanlarda, şiddetli akut solunum sendromu koronavirüs 2'nin (SARS-CoV-2) neden olduğu koronavirüs hastalığı 2019'un (COVID-19), SARS-CoV-2-naif bireylerden gelen kan hücrelerine kıyasla azalmış eritrosit deformabilitesi ve azalmış lenfosit ve nötrofil sertliği de dahil olmak üzere kan hücrelerinin mekanik özelliklerindeki değişikliklerle vurgulandığı gösterilmiştir6.
Genel olarak, hücrelerin ve dokuların mekaniği doğal olarak iç içe geçmiştir: her doku, aynı anda bileşen hücrelerin ve hücre dışı matrisin (ECM) özelliklerini etkileyen ve bunlara bağlı olan spesifik mekanik özelliklere sahiptir5. Bu nedenle, biyolojideki mekaniği incelemek için stratejiler genellikle bu uyaranlara yanıt olarak hücre davranışını aydınlatmak için fizyolojik olarak ilgili mekanik uyaranlara sahip mühendislik substratlarını içerir. Örneğin, Engler ve meslektaşları tarafından yapılan seminal çalışma, mezenkimal kök hücre linaj taahhüdünün, yumuşak ve sert iki boyutlu poliakrilamid (PAAm) hidrojeller7 üzerinde çalışıldığı gibi, matris elastikiyeti tarafından kontrol edildiğini göstermiştir.
İncelenen biyomateryali mekanik olarak karakterize etmek için, mekansal ölçekte (yani, yerelden topluya) ve deformasyon modunda (örneğin, eksenel vs makas) değişen, sonuç olarak farklı bilgiler veren ve dikkatli bir şekilde yorumlanması gereken birçok strateji vardır 3,8,9,10. Yumuşak biyomalzemelerin mekaniği genellikle sertlik açısından ifade edilir. Bununla birlikte, sertlik hem malzeme özelliklerine hem de geometriye bağlıdır, oysa elastik modüller bir malzemenin temel özellikleridir ve malzemenin geometrisinden bağımsızdır11. Bu nedenle, farklı elastik modüller belirli bir numunenin sertliği ile ilgilidir ve her elastik modül, malzemenin farklı sınır koşulları altında (örneğin, serbest genleşme ve hapsetme) belirli bir deformasyon moduna (örneğin, eksenel vs kesme) karşı direncini kapsar11,12. Nanogirinti deneyleri, biyomateryal yanal olarak sınırlandırılmadığında tek eksenli deformasyon (girinti) ile ilişkili olan E yoluyla mekanik özelliklerin nicelleştirilmesine izin verir10,11,12.
Biyolojik sistemlerin E'sini mikro ölçekte ölçmek için en popüler yöntem AFM 13,14,15,16'dır. AFM, pN seviyesine kadar kuvvet çözünürlüğü ve nm'nin altındaki ölçeğe kadar uzamsal çözünürlüğe sahip son derece güçlü bir araçtır. Ayrıca, AFM, tamamlayıcı optik ve mekanik aletlerle birleştirme açısından aşırı esneklik sunarak, soruşturma altındaki biyomalzemeden zengin bir bilgi elde etme yeteneklerini genişletir13. Bununla birlikte, bu çekici özellikler, deneysel kurulumun karmaşıklığı ile temsil edilen bir giriş engeli ile birlikte gelir. AFM, kullanıcıların sağlam veriler elde etmeden önce kapsamlı bir eğitim gerektirir ve biyolojik malzemelerin günlük mekanik karakterizasyonu için kullanımı, özellikle benzersiz kuvveti ve uzamsal çözünürlükleri gerekli olmadığında, genellikle haksızdır.
Bu nedenle, yeni bir nanoindenter sınıfı, kullanım kolaylığı nedeniyle son zamanlarda popülerlik kazanırken, nN altı kuvvet çözünürlüğü ve μm uzamsal çözünürlüğü ile AFM ile karşılaştırılabilir veriler sunarken, ilgili uzunluk ölçekleri2 üzerindeki hücreler tarafından uygulanan ve algılanan kuvvetleri yansıtmaktadır. Özellikle, optik fiber algılama teknolojisine dayanan yüksük üstü nanogirinti cihazları17,18, mekanobiyoloji ve ötesinde aktif araştırmacılar arasında popülerlik kazanmıştır; ve bu cihazları kullanan biyomalzemelerin mekanik özelliklerini bildiren çok sayıda eser, hücreler19,20, hidrojeller8,21 ve dokular 22,23 yayınlanmıştır. Bu sistemlerin yerel dinamik mekanik özellikleri (yani, depolama ve kayıp modülü) araştırma yeteneklerine rağmen, E üreten yarı-statik deneyler en popüler seçenek olmaya devam etmektedir 8,19,20,21. Kısacası, yarı-statik nanogirinti deneyleri, numunenin maksimum yer değiştirme, kuvvet veya girinti derinliği ile tanımlanan bir ayar noktasına kadar sabit bir hızla girintilenmesi ve konsol hem kuvvetinin hem de dikey konumunun kuvvet-mesafe (F-z) eğrileri olarak adlandırılan şekilde kaydedilmesinden oluşur. F-z eğrileri daha sonra temas noktasının (CP) tanımlanmasıyla kuvvet-girinti (F-δ) eğrilerine dönüştürülür ve E'yi hesaplamak için uygun bir temas mekaniği modeli (genellikle Hertz model13) ile donatılmıştır.
Yüksük üstü nanoindenterlerin çalışması AFM ölçümlerine benzese de, dikkate alınması gereken özellikler vardır. Bu çalışmada, bu ve diğer benzer cihazları kullanan araştırma grupları arasında deneysel prosedürlerin standardizasyonunu teşvik etmek için, ticari olarak temin edilebilen bir yüksük üstü nanoindenter kullanarak hücrelerden ve doku taklit eden hidrojellerden F-z eğrilerini sağlam bir şekilde elde etmek için adım adım bir kılavuz sağlanmıştır. Ek olarak, nanogirinti deneylerini gerçekleştirmek için hidrojel numunelerinin ve hücrelerinin en iyi şekilde nasıl hazırlanacağına dair tavsiyeler, deneysel yol boyunca sorun giderme ipuçlarıyla birlikte verilmektedir.
Ayrıca, nanogirinti sonuçlarındaki değişkenliğin çoğu (yani, E ve dağılımı), önemsiz olmayan verileri analiz etmek için kullanılan spesifik prosedüre bağlıdır. Bu sorunu çözmek için, Python'da programlanmış ve F-z eğrilerinin toplu analizi için kullanıcı dostu bir grafik kullanıcı arayüzü (GUI) ile donatılmış yeni geliştirilmiş bir açık kaynaklı yazılımın kullanımına yönelik talimatlar sağlanmaktadır. Yazılım, hızlı veri taramasına, verilerin filtrelenmesine, CP'nin farklı sayısal prosedürlerle hesaplanmasına, E'nin geleneksel hesaplamasına ve ayrıca hücrenin toplu Young modülünü, aktin korteksin Young modülünü ve aktin korteksin kalınlığını tahmin etmeyi sağlayan elastikiyet spektrumu24 adlı daha gelişmiş bir analize izin verir. Yazılım GitHub'dan ücretsiz olarak indirilebilir ve uygun bir veri ayrıştırıcısı ekleyerek diğer sistemlerden kaynaklanan verileri analiz etmek için kolayca uyarlanabilir. Bu protokolün diğer yüksük üstü nanoindentasyon cihazları ve genel olarak diğer nanoindentasyon cihazları için kullanılabileceği, bazı adımların belirli bir cihazın yönergelerine göre uyarlandığı vurgulanmaktadır. Protokol şematik olarak Şekil 1'de özetlenmiştir.
Protokol
1. Nanogirinti ölçümleri için substratların / hücrelerin hazırlanması
- Nanogirinti deneyleri için PAAm hidrojellerinin / hücrelerinin hazırlanması için Ek Protokolde verilen adımları izleyin. Prosedür Şekil 2'de özetlenmiştir.
NOT: PAAm hidrojelleri, mekanobiyoloji alanında kullanılan en yaygın hidrojeller oldukları için seçilmiştir. Bununla birlikte, protokol her türlü hidrojel25 için eşit derecede geçerlidir (bkz.
2. Cihazın başlatılması, prob seçimi ve prob kalibrasyonu
- Cihazı başlatmak için Ek Protokol'de verilen adımları izleyin. Optik fiber yüksük üstü nanoindenterlerin çalışması hakkında teknik ayrıntılar için, bu referansları kontrol edin17,18.
- Nanogirinti probunu aşağıda açıklandığı gibi seçin.
NOT: Bu protokolde kullanılanlar gibi piyasada bulunan tüm problar küresel bir uçla donatılmıştır (Şekil 3A). Bu nedenle, seçim iki değişkene indirgenir: konsol sertliği ve uç yarıçapı (Şekil 3B).- En iyi sonuçlar için beklenen numune sertliği ile eşleşen bir konsol sertliği (N/m cinsinden k) seçin15 (bkz. Şekil 3C ve Tartışma, protokoldeki kritik adımlar). Hücreler için, 0,01-0,09 N/m aralığında k içeren bir prob seçin. Hidrojeller için, birkaç kPa ile 100 kPa arasında beklenen E'ye sahip jeller için optimum sonuçlar veren 0,1-0,9 N/m aralığında k içeren bir prob seçin (bkz.
- Girinti işleminin istenen uzamsal çözünürlüğüne göre uç yarıçapını (μm cinsinden R) seçin. İnsan Embriyonik Böbrek 293T (HEK293T) hücreleri gibi küçük hücreler için (ortalama çap ~ 10-15 μm26) R = 3 μm olan bir küre seçin. Hidrojeller için, biyomalzemenin mekanik özelliklerini geniş bir temas alanı üzerinde araştırmak ve yerel heterojenliklerden kaçınmak için R = 10-250 μm olan bir küre seçin.
- Uygun probu seçmek için Şekil 3C'ye ve ek üretici yönergelerine bakın.
- Prob seçildikten sonra, nanoindenter üzerine monte etmek için Ek Protokoldeki adımları izleyin.
3. Prob kalibrasyonu
NOT: Aşağıdaki adımlar, optik fiber algılama teknolojisine dayanan yüksük üstü nanogirinti aygıtlarına özgüdür ve yazılım sürümü 3.4.1 için ayrıntılandırılmıştır. Diğer nanogirinti aygıtları için, aygıt üreticisi tarafından önerilen adımları izleyin.
- Yazılımın ana penceresinde, Başlat'a tıklayın. Bir kalibrasyon menüsü görünecektir. Prob ayrıntılarını girin (probun kutusunun yan tarafında bulunabilir; giriş kutularında N /m'de k, μm'de R ve havadaki kalibrasyon faktörü) bulunur.
- Kalibrasyon kabını hazırlayın: düz tabanlı kalın bir cam Petri kabı (bkz. Tartışma, protokoldeki kritik adımlar). Tabağı, numune tabağıyla aynı ortamla doldurun (bu aynı zamanda hava da olabilir). Ortamın sıcaklığını numuneninkiyle eşleştirin.
- Kalibrasyon kabını probun altına yerleştirin. Gerekirse, probu nanoindenter'ın kol tutucusundan dışarı kaydırın ve kalibrasyon kabının yerleştirilmesi için yer açmak için bir elinizde tutun. Probu yerine geri kaydırın.
- Sıvı içinde kalibrasyon için sonraki iki adımı uygulayın. Havada ölçüm yapıyorsanız, kalibrasyon için birlikte verilen politetrafloroetilen substratı kullanın ve adım 5'e atlayın.
- Damlanın konsol ve küresel uç27 üzerinde kayması için pipetin ucu cam yüksükle hafif temas halinde olan bir Pasteur pipet kullanarak probu %70 etanol damlası ile önceden ıslatın (bkz.
- Prob tamamen suya batırılana kadar nanoindenter'ın kolunu manuel olarak aşağı doğru kaydırın, ancak yine de Petri kabının dibinden çok uzakta. Gerekirse, kalibrasyon kabına daha fazla ortam ekleyin. Sıvıda denge koşullarına ulaşılması için 5 dakika bekleyin.
- Yazılımın Başlat menüsünde, Dalga Boyunu Tara'ya tıklayın. İnterferometrenin ekranında bir ilerleme çubuğu ve bilgisayarın yazılımındaki Canlı Sinyal penceresi soldaki Şekil S1A'da gösterilen deseni gösterecektir. Optik taramanın başarılı olup olmadığını kontrol etmek için, interferometre kutusundaki Dalga Boyu Taraması paneline gidin. Başarılı olursa, bir sinüs dalgası görünür olmalıdır (Şekil 1A, sağda). Bir hata görüntülenirse Tartışma (yöntemin sorun giderme) bölümüne bakın.
- Başlat menüsünde, konsol bükülmesinde ayarlanmış bir eşiğe ulaşılana kadar probu kademeli olarak düşürecek olan Yüzeyi Bul'a tıklayın. Prob, cam Petri kabı ile temas ettiğinde hareket etmeyi durdurur.
- Probun yüzeyle temas halinde olup olmadığını kontrol edin. Yazılımın ana penceresindeki y aşağı ok düğmesini kullanarak probu 1 μm aşağı doğru hareket ettirin. Konsol substratla temas halindeyken, her adımda taban çizgisindeki değişiklikler için yazılımın Canlı Penceresindeki yeşil sinyali (konsol sapması) gözlemleyin (Şekil S1B). Herhangi bir değişiklik yoksa, konsol temas halinde değildir (bir sonraki adıma bakın).
- Yüzey Bul sekmesinin altındaki Seçenekler menüsündeki Eşik değerini, varsayılan değeri olan 0,01'den bir seferde 0,01'lik bir adımla artırın ve Yüzeyi Bul adımını temas kurana kadar yineleyin. Alternatif olarak, yeşil taban çizgisi aşağı doğru her adımda kaymaya başlayana kadar probu küçük 1 μm adımlarla temas edecek şekilde aşağı indirin.
NOT: En yumuşak konsollar için (k = 0,025 Nm-1), Yüzeyi Bul sekmesinin altındaki Seçenekler menüsündeki Eşik değerini 6. adımı gerçekleştirmenin a priori olarak artırın. 0,06 veya 0,07 eşik değerinden başlayın ve gerekirse 0,1'e yükseltin. Bunun nedeni, çevresel gürültünün muhtemelen konsol temastan önce eşiğin üzerinde bükülmesine neden olmasıdır. Yumuşak problar için, aynı menüdeki Yaklaşma Hızının (μm/s) azaltılması da prosedürü iyileştirir. - Başlat menüsünde, Kalibre Et'e tıklayın.
- Yazılımın Canlı Sinyal penceresini kontrol edin ve hem piezo'nun yer değiştirmesinin hem de konsol saptırma sinyallerinin aynı anda yukarı doğru hareket ettiğinden emin olun (Şekil S1C).
- Zaman içinde bir uyumsuzluk varsa, prob camla tam olarak temas halinde değildir. Konsol sinyalinin taban çizgisi değişene kadar probu 1 μm'lik adımlarla aşağı doğru hareket ettirin (bkz. adım 7) ve adım 9'u tekrarlayın.
- Kalibre Et adımı sırasında konsol sinyali hiç değişmezse, prob yüzeyden uzaktır. Yüzey doğru bulunana kadar temas eşiğini yinelemeli olarak artırın (bkz. adım 8) ve dalga boyu taramasından başlayarak kalibrasyonu baştan itibaren tekrarlayın.
- Kalibrasyon tamamlandığında, görüntülenen açılır pencerede eski ve yeni kalibrasyon faktörlerini kontrol edin. Yeni kalibrasyon faktörü doğru aralıktaysa, Yeni Faktör Kullan'a tıklayın. Kalibrasyon başarısız olursa ve yeni faktör NaN ise veya beklenen aralıkta değilse, çözüm için Tartışma (yöntemin sorun giderme) bölümüne bakın.
NOT: Yeni faktör, kalibrasyon kırılma indisi n (su için n = 1.33) olan sıvı bir ortamda gerçekleştirilmişse, probun kutusunda sağlanandan ~ n kat daha düşük olmalıdır. Kalibrasyon havada yapılmışsa, yeni ve eski kalibrasyon faktörleri yaklaşık olarak eşit olmalıdır. - Demodülasyon çemberinin aşağıdaki gibi doğru şekilde kalibre edilip edilmediğini kontrol edin. İnterferometre masaüstündeki Demodülasyon sekmesine gidin. Yeterli gürültüyü tetiklemek için optik masaya veya nanoindenter'a hafifçe dokunun. Ayrık veri noktalarından oluşan beyaz bir daire, kırmızı daireyi yaklaşık olarak örtmelidir (Şekil S1D).
- Beyaz daire kırmızı daireyle örtüşmüyorsa veya interferometrenin ekranında bir uyarı belirirse, demodülasyon çemberinin yeniden kalibre edilmesi gerekir. Bu, aşağıda açıklandığı gibi iki şekilde yapılabilir.
- Tam bir gürültü çemberi oluşturmak için nanoindenter'ın gövdesine sürekli dokunun ve interferometre üzerindeki Kalibre Et düğmesine basın.
- Cam alt tabaka ile temas halinde girin ve yazılımın ana penceresinin Başlat menüsünden Kalibre Et düğmesine basın. Kalibrasyon faktörünü kaydetmeyin. Bu noktada, tekrar kontrol edin ve beyaz dairenin kırmızı daireyle üst üste bindiğinden emin olun.
NOT: Sinyal sadece demodülasyon çemberinden hafifçe yer değiştirmekle kalmaz, aynı zamanda çok küçülürse veya hiç görünmezse, konsol optik fibere yapışmış demektir. Bu sorunla ilgili sorun giderme önerilerini izleyin (bkz: Tartışma, yöntemle ilgili sorun giderme) ve 13.1 veya 13.2 numaralı adımları yineleyin. Konsol yatay konumuna geri döndüğünde (Şekil 3A), sinyal demodülasyon çemberine geri dönecektir.
- Aşağıda açıklandığı gibi kalibrasyondan hemen sonra cam alt tabaka üzerinde bir girinti gerçekleştirerek kalibrasyonu doğrulayın.
- Denemeyi Yapılandır'ı tıklayarak bir deneme dosyası yükleyin veya yapın ve bir Yüzeyi Bul adımı ve Girinti adımı ekleyin. Girinti adımında, varsayılan yer değiştirme modu ayarlarını kullanın ve probu sert alt tabakaya karşı yer değiştirmek için maksimum yer değiştirmeyi kalibrasyon mesafesine (3.000 nm) değiştirin.
- Deneyi Çalıştır'a tıklayın ve interferometre penceresindeki demodülasyon dairesini kontrol edin. Beyaz sinyali kontrol edin ve girinti sırasında kırmızı dairenin üstünde olduğundan emin olun.
- Zaman Verileri grafiğindeki yazılımın ana penceresindeki sonuçları kontrol edin ve girinti temas halinde başladığından ve malzeme deformasyonu beklenmediğinden piezo'nun yer değiştirmesinin (mavi çizgi) konsol sapmasına (yeşil çizgi) eşit olduğundan emin olun. Sinyaller paralel değilse, bkz: Tartışma (yöntemin sorun giderme).
- Kalibrasyon Kayıt Yolu'nu uygun bir dizine ayarlayarak kalibrasyon menüsündeki yerel yolu değiştirin.
- Prob başarıyla kalibre edildiğinde, piezo'yu 500 μm yukarı doğru hareket ettirin.
4. Yumuşak malzemelerin Genç Modülünün Ölçülmesi
- Hidrojellerin nanogirintisi
- Numuneleri içeren Petri kabını mikroskop aşamasına yükleyin ve nanoindenterin probunu numunenin üzerinde istenen bir x-y konumuna manuel olarak hareket ettirin.
- Probu manuel olarak çözelti içinde kaydırın, bu aşamada prob ile numunenin yüzeyi arasında 1-2 mm bırakmaya dikkat edin. Probun ortamda dengelenmesi için 5 dakika bekleyin.
- Optik mikroskobun z düzlemini odaklayın, böylece prob açıkça görülebilir.
- Deneysel parametreleri aşağıda açıklandığı gibi ayarlamak için tek bir girinti gerçekleştirin.
- Yazılımın ana penceresinde yeni bir deneme yapılandırın. Yeni bir pencere açacak olan Denemeyi Yapılandır'a tıklayın. Bir Yüzeyi Bul adımı ekleyin. Yüzeyi Bul adımının tüm parametreleri, gerekirse yazılımın Seçenekler menüsünden değiştirilebilir.
NOT: Bul Yüzeyi , yüzey bulunana kadar probu alçaltır ve daha sonra probu, numunenin yüzeyinin üzerinde, Z Above Surface (μm) tarafından tanımlanan bir mesafeye geri çeker. Seçilen konsol numune için çok sertse veya numune yapışkansa, adımdan sonra probun numune ile hala temas halinde olması muhtemeldir, bu da taban çizgisi olmayan bir eğriye neden olur (Şekil 4C). Bu sorunu çözmek için, Z Yüzey Üstü (μm) değerini artırın. - Bir Girinti adımı ekleyin. Profil sekmesini seçin ve Yer Değiştirme Kontrolü'ne tıklayın. Varsayılan girinti profilini olduğu gibi bırakın.
- Ana yazılım penceresinde Denemeyi Çalıştır'a tıklayın. Bu, yüzeyi bulacak ve tek bir girinti gerçekleştirecektir. Tek girinti beklendiği gibi görünmüyorsa, deneysel parametreleri Şekil 4 ve Tartışma'da (yöntemin sorun giderme) belirtildiği gibi ayarlayın.
- Yazılımın ana penceresinde yeni bir deneme yapılandırın. Yeni bir pencere açacak olan Denemeyi Yapılandır'a tıklayın. Bir Yüzeyi Bul adımı ekleyin. Yüzeyi Bul adımının tüm parametreleri, gerekirse yazılımın Seçenekler menüsünden değiştirilebilir.
- Girinti istenildiği gibi göründüğünde, matris taramasını numunenin yeterli bir alanı girintilenecek şekilde yapılandırın. Deneyi Yapılandır'a tıklayın, önceden belirlenmiş deneysel parametrelerle bir Yüzeyi Bul adımı ekleyin ve bir Matris Tarama adımı ekleyin.
- Düz hidrojeller için, 10-100 μm'de aralıklı 50-100 nokta (yani, x ve y'de 5 x 10 veya 10 x 10) içeren bir matris taraması yapılandırın (yani, dx = dy = 10-100 μm). Matris taramasını geçerli sahne alanı konumundan başlatmak için Sahne Alanı Konumunu Kullan'a tıklayın. Ayarlanan deneysel parametreleri kullanarak her girintideki yüzeyi bulmak için Yüzeyi Otomatik Bul kutusunun işaretli olduğundan emin olun.
- Aşırı örneklemeyi önlemek için, adım boyutunu temas yarıçapının en az iki katına ayarlayın (
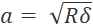 burada δ girinti derinliğidir).
burada δ girinti derinliğidir). - Yer değiştirme kontrolünde matris tarama profilini ayarlayın. Profilin Hertz modelinin varsayımlarını ihlal etmediğinden emin olun (bkz.
- Segment sayısını varsayılan değer olan 5 olarak bırakın ve varsayılan yer değiştirme profilini kullanın. Gerekirse, yer değiştirme profilini, sırasıyla maksimum girinti derinliğini ve gerinim oranını etkileyecek olan her eğimli segment için maksimum yer değiştirme ve zaman açısından değiştirin. Gerinim oranlarını 10 μm/s'> aşmayın (bkz.
- Probun temastan önce numuneye doğru ne kadar hızlı yer değiştirdiğini belirleyen yaklaşma hızı için bir değer girin. Geri çekme hızını yaklaşma hızıyla eşleştirin (aşağıdaki nota bakın).
NOT: Yumuşak konsollar ve gürültülü ortamlar için 1.000-2.000 nm/sn yaklaşım hızı önerilir. Daha sert konsollar ve kontrollü ortamlar için bu artırılabilir. - Yapılandırılan denemeyi istediğiniz Deneme Yolu'na kaydedin ve verilerin Denemeyi Yapılandır penceresinin Genel sekmesindeki Kayıt Yolu'na kaydedileceği bir dizin seçin. Denemeyi Çalıştır'a tıklayın.
- Aşırı örneklemeyi önlemek için, adım boyutunu temas yarıçapının en az iki katına ayarlayın (
- Matris taraması tamamlandıktan sonra, probu 200-500 μm yükseltin ve probu numunenin ilk alandan yeterince uzaktaki farklı bir alanına taşıyın.
- Her numune hakkında yeterli veri elde edilmesi için deneyi en az iki kez tekrarlayın (yani, her biri 50-100 eğri içeren numune başına en az iki matris taraması).
- Hücrelerin nanogirintisi
- Numuneyi yukarıda açıklandığı gibi mikroskopa yükleyin.
- Tek hücreli girinti için, z düzlemini odaklayın, böylece hücre boyutuna ve yayılmasına bağlı olarak hem hücreler hem de prob 20x veya 40x büyütmede görülebilir.
- Probu, girintilenecek hücrenin üzerine taşıyın.
- Yazılımın ana penceresinde yeni bir deneme yapılandırın. Yeni bir pencere açacak olan Denemeyi Yapılandır'a tıklayın. Yer değiştirme modunda varsayılan parametrelerle bir Yüzey Bul ve Girinti adımı ekleyin.
- Yüzeyi bulacak ve tek bir girinti gerçekleştirecek olan Denemeyi Çalıştır'a tıklayın. Girintinin başarılı olup olmadığını denetleyin. Eğri beklendiği gibi görünmüyorsa, deneysel parametreleri ayarlayın (bkz. Şekil 4 ve Tartışma, yöntemin sorun giderme).
- Girinti başarılı olduysa, denemeye bir matris taraması ekleyin. Hidrojellerin nanoindentasyon deneyleri için verilen adımları izleyin; matris taramasını, adım boyutunun hücrenin küçük bir alanının girintilenmesine izin verecek şekilde yapılandırın; HEK293T hücreleri için 0,5-5 μm'de aralıklı 25 nokta.
- Hücre boyutuna bağlı olarak, ucun hücre sınırının dışına çıkmamasını sağlamak için matris taramasını uyarlayın, yani farklı bir harita geometrisi yapın veya daha az noktayı araştırın.
- Denemeyi Çalıştır'a tıklayın ve tamamlanmasını bekleyin.
- Matris taraması tamamlandıktan sonra, probu temastan kaldırın ( z düzleminde 50 μm).
- Probu yeni bir hücrenin üzerine taşıyın ve işlemi tekrarlayın (bkz. Tartışma, protokoldeki kritik adımlar).
- Probun temizlenmesi ve cihazın kapatılması
- Probu temizlemek ve nanogirinti cihazını kapatmak için Ek Protokol'de verilen adımları izleyin.
5. Veri analizi
- Yazılımı indirme ve yükleme
- Veri analizi28,29 yazılımını indirmek ve yüklemek için Ek Protokol'de verilen adımları izleyin.
- F-z eğrilerinin taranması ve temizlenmiş veri setinin JSON formatında üretilmesi
- prepare.py 2 ile 3 arasındaki adımlarda özetlendiği gibi laboratuvar bilgisayarındaki komut satırından başlatın.
- Bir Windows bilgisayar kullanıyorsanız, NanoPrepare klasörüne sağ tıklarken shift tuşunu basılı tutun ve PowerShell Penceresini Burada Aç'a tıklayın. Python prepare.py komutunu yazın ve Enter tuşuna basın. Ekranınızda bir GUI açılacaktır (Şekil S2).
- Bir MacOS bilgisayar kullanıyorsanız, NanoPrepare klasörüne sağ tıklayın ve Klasördeki Yeni Terminal'e tıklayın. python3 prepare.py komutunu yazın ve GUI'yi başlatacak olan Enter tuşuna basın (Şekil S2).
- Açılır listeden O11YENİ veri biçimini seçin. Veriler doğru yüklenmezse, GUI'yi yeniden başlatın ve O11OLD'yi seçin.
NOT: O11YENİ formatı, yazılım sürümü 3.4.1 olan yüksük üstü optik fiber algılama nanogirinti cihazları kullanılarak elde edilen veriler için çalışır. Bu format, en azından 2019-2020'de kurulan nanoindenderlere ait olanlar olmak üzere önceki yazılım sürümleri için de çalışacaktır. - Klasörü Yükle'ye tıklayın. Analiz edilecek verileri içeren bir klasör seçin-tek matrisli tarama veya çoklu matris taramaları. Üst grafik (Ham Eğriler) yüklenen veri kümesiyle doldurulur. Belirli bir eğriyi görselleştirmek için üzerine tıklayın. Bu, yeşil renkte vurgulayacak ve alt grafikte (Geçerli Eğri) gösterecektir.
- Aşağıda özetlendiği gibi GUI'nin sağ tarafında bulunan sekmeleri kullanarak veri kümesini temizleyin.
- F-z eğrilerinin ileri segmenti olan analiz edilecek doğru segmenti seçmek için Segment düğmesini kullanın. Belirli sayı, deneyler yapılırken nanoindentasyon yazılımında seçilen segment sayısına bağlıdır.
- Eğrileri en solda (L işaretliyse), sağda (R işaretliyse) veya her iki tarafta (hem R hem de L işaretliyse) 50 nm kırpmak için 50 nm kırpın düğmesini kullanın. Gerektiği kadar kırpmak için bu düğmeyi birkaç kez tıklatın. F-z eğrilerinin başında/sonunda bulunan yapıları kaldırmak için bunu kullanın.
- Konsol tırnağını yay sabiti, uç geometrisi ve uç yarıçapı açısından inceleyin. Meta verilerin doğru okunduğundan emin olmak için sekmeyi inceleyin.
- Verilen kuvvete ulaşmayan tüm eğrileri atacak bir kuvvet eşiği ayarlamak için Tarama sekmesini kullanın. Atılan eğriler kırmızı renkle vurgulanır.
- Doğru şekilde alınmamış eğrileri el ile kaldırmak için Manuel Geçiş düğmesini kullanın . Belirli bir eğriye tıklayarak ve eğriyi kırmızı renkle vurgulayacak olan OUT'u seçerek eğrileri kaldırın.
- JSON'u Kaydet'e tıklayın. Temizlenen veri kümesi için tek bir JSON dosyası olan uygun bir ad girin. JSON dosyasını NanoAnalysis yazılımının yüklü olduğu bilgisayara gönderin.
6. Resmi veri analizi
- NanoAnalysis klasörüne gidip daha önce açıklandığı gibi bir terminal başlatarak komut satırından nano.py dosyasını başlatın. Python nano.py veya python3 nano.py komutunu yazın (işletim sistemine bağlı olarak) ve Enter tuşuna basın. Ekranınızda bir GUI açılacaktır (Şekil S3).
- GUI'nin sol üst köşesinde, Denemeyi Yükle'ye tıklayın ve JSON dosyasını seçin. Bu, dosya listesini ve veri kümesini F-z eğrileri cinsinden gösteren Ham Eğriler grafiğini doldurur. Hem F hem de z eksenleri, veri kümesi yüklenirken arka planda hesaplanan CP koordinatlarına göre gösterilir (aşağıdaki nota bakın). İstatistikler kutusunda, üç parametrenin değerlerini işaretleyin: Netkinleştirildi, N başarısız oldu ve Nhariç tutuldu.
NOT:Etkinleştirilen N, sonraki Hertz/elastikiyet spektrumları analizinde analiz edilecek eğrilerin sayısını temsil eder ve Ham Eğriler grafiğinde siyah renkte görünür. Nbaşarısız , güvenilir bir CP'nin bulunamadığı eğrilerin sayısını temsil eder ve grafikte mavi renkte görünür. Bu eğriler sonraki analizde otomatik olarak atılacaktır. Yazılımı açtıktan sonra, bazı eğriler otomatik olarak başarısız kümeye taşınabilir. Bunun nedeni, CP'nin yazılımın varsayılan Eşik algoritmasıyla açılmasıyla hesaplanmasıdır (aşağıya bakın). N hariç tutuldu, analizdenhariç tutulmak üzere manuel olarak seçilen eğrileri temsil eder ve grafikte kırmızı renkte görünür (aşağıya bakın). - Başarısız, dışlanan ve etkinleştirilen eğrilerin sayısının makul olup olmadığını denetleyin. Eğrileri görselleştirmek için Ham Eğriler grafiğini kontrol edin.
- Belirli bir eğriyi daha ayrıntılı olarak görselleştirmek için üzerine tıklayın. Bu, yeşil renkte vurgulanır ve Geçerli Eğri grafiğinde gösterilir. Tek bir eğri seçildikten sonra, R ve k parametreleri (tüm eğriler için aynı olmalıdır) GUI'nin İstatistikler kutusuna doldurulur.
- Geçiş kutusunu kullanarak belirli bir eğrinin durumunu değiştirin. Durumunu değiştirmek istediğiniz belirli eğriye tıklayın ve ardından Etkin, Başarısız veya Hariç Tutulanlara tıklayın. İstatistikler kutusundaki sayı otomatik olarak güncellenir.
NOT: Ham Eğriler grafiğindeki veri kümesinin görünümünü değiştirmek için Görünüm kutusunu kullanın. Tüm eğrileri göstermek için Tümü'ne tıklayın (yani, ilgili renklerde etkinleştirildi, başarısız oldu ve hariç tutuldu). Etkinleştirilen ve başarısız eğrileri göstermek için Başarısız üzerine tıklayın ve yalnızca etkinleştirilen eğrileri göstermek için Etkinleştirildi'ye tıklayın. Etkinleştirilen ve hariç tutulan arasındaki tüm eğrilerin durumunu sıfırlamak için, Sıfırla kutusunda Etkinleştirildi veya Hariç Tutuldu'ya tıklayın. - Veri kümesi daha fazla temizlendikten sonra, aşağıda özetlenen veri analizi işlem hattını izleyin.
- GUI'de (Filtreleme Kutusu) uygulanan filtreleri, yani Belirginlik filtresi, Savitzky Golay30,31 (SAVGOL) filtresi ve belirli bir penceredeki verilerin medyanını hesaplamaya dayalı bir yumuşatma filtresi (medyan filtresi) adı verilen özel bir filtreyi kullanarak eğrilerde bulunan gürültüyü filtreleyin. Filtrelerle ilgili ayrıntılar için Tartışma (protokoldeki kritik adımlar) bölümüne bakın.
- Geçerli Eğri grafiğindeki filtrelenmiş eğrileri inceleyin. Filtrelenmiş eğri siyah, eğrinin filtrelenmemiş versiyonu ise yeşil renkle gösterilir.
NOT: Orijinal sinyalin özelliklerini korumak için verileri mümkün olduğunca az filtrelemeniz önerilir. Aşırı filtreleme, verilerde bulunan farklılıkları düzeltebilir. Etkinleştirilen belirginlik filtresi ile çalışmak, nanogirinti verilerinin Hertz analizi için yeterlidir. Veriler özellikle gürültülüyse, ek olarak bir SAVGOL veya medyan filtresi uygulanabilir. - CP'yi bulmak için bir algoritma seçin. Temas Noktası kutusunda, yazılımda uygulanmış olan bir dizi sayısal yordamdan birini seçin: Uyumun İyiliği (GoF)32, Varyansların Oranı (RoV)32, İkinci türev 33 veya Eşik33. Algoritmalarla ilgili ayrıntılar için Tartışma, protokoldeki kritik adımlar bölümüne bakın.
NOT: CP, probun malzeme ile temas ettiği noktadır ve F-z verilerini F-δ verilerine dönüştürmek için tanımlanması gerekir (yumuşak malzemeler için δ sonludur ve hesaplanması gerekir). Seçilen algoritma, veri kümesinin tüm etkin eğrilerine uygulanır ve algoritmanın CP'yi sağlam bir şekilde bulamadığı eğriler başarısız kümeye taşınır. - Algoritmanın parametrelerini veri kümenize uyacak şekilde ayarlayın, böylece CP, protokoldeki Tartışma, kritik adımlarda ayrıntılı olarak açıklandığı gibi doğru şekilde bulunur. CP'nin tek bir eğride nerede bulunduğunu görmek için, üzerine tıklayarak eğriyi seçin ve İncele'ye tıklayın. CP'nin nerede bulunduğunu belirlemek için görünen açılır pencereyi kontrol edin.
- Seçilen ilgili bölgede algoritmanın hesapladığı parametre olan görünen kırmızı çizginin, CP'nin konumuna karşılık gelen maksimum veya minimum bir değere sahip olup olmadığını kontrol edin (örneğin, GoF için parametre R2'dir). Gerekirse tüm eğriler için bu işlemi tekrarlayın.
NOT: Açılır pencerenin eksenleri mutlak koordinatlar halindedir, böylece CP'nin konumu gösterilebilir. Tersine, Ham Eğriler ve Akım Eğrisi grafiğinin eksenleri CP'ye göre gösterilir, yani CP'nin konumu (0,0) dır. - Hertz Analizi'ne tıklayın. Bu, aşağıda açıklanan üç grafik oluşturacaktır.
- Veri kümesindeki tek tek F-δ eğrilerini ortalama Hertz uyumuyla (kırmızı kesikli çizgi) birlikte kontrol edin. Maksimum Girinti (nm) altındaki Sonuçlar kutusunda Hertz modelinin takılı olduğu nm cinsinden girintiyi ayarlayın. Hertz modelinin geçerli olması için bunu R'nin en fazla ~%10'una ayarlayın (bkz.
- Ortalama F-δ eğrisini, ortalama Hertz uyumu (kırmızı kesikli çizgi) ile birlikte bir standart sapma (SD) gösteren hata bandıyla kontrol edin. Referans için Ham Eğriler grafiğine ortalama Hertz sığışını ve Geçerli Eğrideki her eğri için Hertz uyumunu görselleştirin.
- E'nin Hertz modelinin her bir eğriye sığdırılmasından kaynaklanan dağılım grafiğini kontrol edin.
- Her grafikteki eğriyi vurgulamak için dosya adına, F-z eğrisine, F-δ eğrisine veya dağılım grafiğindeki bir noktaya tıklayın. Dağılım grafiğindeki bir veri noktası, verilerin dağılımının dışında kalıyor gibi görünüyorsa, üzerine tıklayın ve ait olduğu eğriyi inceleyin. İncele düğmesine tıklayarak CP'nin doğru şekilde bulunup bulunmadığını doğrulayın. Gerekirse eğriyi analizden hariç tutun.
- Hesaplanan ortalama E ve SD (Eγ ± σ) için Sonuçlar kutusunu inceleyin ve verilen deney için makul olduklarından emin olun.
- Kaydet kutusunda, Hertz'e tıklayın. Açılır pencereye dosya adını ve dizinini girin. İşiniz bittiğinde, Kaydet'e tıklayın. Bir .tsv dosyası oluşturulur. .tsv dosyasını herhangi bir ek tercih yazılımında açın ve istatistiksel analiz ve daha fazla çizim için değerleri kullanın.
NOT: Dosya, her eğriden elde edilen E'yi ve ortalama E ve SD'sini içerir. Ek olarak, dosya, analiz edilen eğrilerin sayısı, R, k ve Hertz modeli için kullanılan maksimum girinti dahil olmak üzere analizle ilişkili meta verileri içerir. - Bu adım isteğe bağlıdır. Ortalama kuvveti ve ortalama girintiyi, kuvvetteki bir SD ile birlikte dışa aktarmak için Ortalama F-Ind'ye tıklayın.
- Hücre nanogirinti verileri için Elastikiyet Spektrumları Analizi'ne tıklayın (bkz. Üretilen iki grafiği, yani her eğri için girinti derinliğinin (E(δ)) bir fonksiyonu olarak E'yi ve hücrenin aktin korteksinin Young modülünü, hücrenin toplu Young modülünü tahmin etmeyi sağlayan bir model (siyah kesikli çizgi) tarafından takılan bir SD (katı kırmızı çizgi ve gölgeli alan) gösteren hata bandına sahip ortalama E (δ) 'yi inceleyin. ve aktin korteksin kalınlığı. Ek olarak, üstteki grafikteki ortalama E(δ) değerini kırmızı renkle kontrol edin.
- Elastikiyet spektrumu analizini gerçekleştirmek için gereken türevin enterpolasyonlu sinyal üzerinde hesaplanmasını sağlayan Interpolate kutusunun işaretli olduğundan emin olun (bkz.
- Korteksin Young modülünü (E 0 ± σ), hücrenin toplu Young modülünü (Eb ± σ) ve korteks kalınlığını (d0 ± σ) bildirerek Sonuç kutusunu inceleyin.
NOT: Ortalama elastikiyet spektrumları ilk başta belirgin sinüzoidal salınımlarla gürültülü görünebilir. Sonuç olarak, denklem (3) doğru şekilde takılmayabilir. Bu durumda, yumuşatıcı SAVGOL filtresi34'ün pencere uzunluğunu yinelemeli olarak artırmak bu sorunu çözer. - Analiz tamamlandığında, Kaydet kutusundaki ES'ye tıklayın. Bu, belirtilen dizinde, ortalama girinti derinliğinin ve temas yarıçapının bir işlevi olarak ortalama esnekliği, denemeyle ilişkili meta verileri (yukarıya bakın) ve yukarıda açıklanan tahmini model parametrelerini içeren bir .tsv dosyasını dışa aktarır. Son olarak, δ ve SD'sine bağımlılığı göz ardı eden ortalama esneklik de bildirilmiştir.
- Yazılımı kapatın ve verileri daha fazla çizmek ve istatistiksel analiz yapmak için kaydedilen sonuçları tercih edilen başka bir yazılıma girin.
- Bu adım isteğe bağlıdır: Grafiğe sağ tıklayıp Dışa Aktar'ı seçerek grafikleri GUI'den dışa aktarın. Grafiği .svg dışa aktarın, böylece yazı tipi, yazı tipi boyutu, çizgi stili vb. Parametreler görünür. tercih edilen başka bir yazılımda düzenlenebilir.
NOT: Özel CP algoritmaları ve filtreleri programlanabilir ve mevcut olanlara eklenebilir. Ayrıntılar için Ek Not 1'e bakın.
Sonuçlar
Protokolü takiben, bir dizi F-z eğrisi elde edilir. Veri kümesi büyük olasılıkla iyi eğriler ve analize devam etmeden önce atılacak eğriler içerecektir. Genel olarak, şekilleri Şekil 4A'da gösterilenden farklıysa eğriler atılmalıdır. Şekil 5AI, NanoPrepare GUI'ye yüklenen beklenen E 0.8 KPa35'in yumuşak bir PAAm hidrojeli üzerinde elde edilen ~ 100 eğriden oluşan bir veri kümesini göstermekted...
Tartışmalar
Bu protokol, hem hidrojeller hem de tek hücreler üzerinde ticari olarak temin edilebilen bir yüksük üstü nanoindenter kullanarak kuvvet spektroskopisi nanogirinti verilerinin sağlam bir şekilde nasıl elde edileceğini göstermektedir. Ek olarak, nanogirinti verilerinin analizi için kesin bir iş akışı içeren Python'da programlanmış açık kaynaklı bir yazılımın kullanımı için talimatlar sağlanmaktadır.
Protokoldeki kritik adımlar
Aşağıdaki adım...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
GC ve MAGO CeMi'nin tüm üyelerini kabul eder. MSS, EPSRC Programı Hibesi (EP/P001114/1) aracılığıyla destek kabul eder.
GC: yazılım (yazılım geliştirme ve algoritmalara katkı), biçimsel analiz (nanogirinti verilerinin analizi), doğrulama, Araştırma (poliakrilamid jeller üzerinde nanogirinti deneyleri), veri kürasyonu, yazma (orijinal taslak, gözden geçirme ve düzenleme), görselleştirme (şekil ve grafikler). MAGO: araştırma (jellerin ve hücre örneklerinin hazırlanması, hücreler üzerinde nanoindentasyon deneyleri), yazma (orijinal taslak, gözden geçirme ve düzenleme), görselleştirme (şekil ve grafikler). NA: doğrulama, yazma (inceleme ve düzenleme). IL: yazılım (yazılım geliştirme ve algoritmalara katkı), doğrulama, yazma (inceleme ve düzenleme); OG: kavramsallaştırma, yazılım (orijinal yazılım ve algoritmaların tasarımı ve geliştirilmesi), doğrulama, kaynaklar, yazma (orijinal taslak, gözden geçirme ve düzenleme), denetim, proje yönetimi, finansman edinimi MSS: kaynaklar, yazma (gözden geçirme ve düzenleme), denetim, proje yönetimi, finansman edinimi. Tüm yazarlar son makaleyi okudu ve onayladı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | VWR | 631-1577P | |
| 35 mm cell treated culture dishes | Greiner CELLSTAR | 627160 | |
| Acrylamide | Sigma-Aldrich | A4058 | |
| Acrylsilane | Alfa Aesar | L16400 | |
| Ammonium Persulfate | Merk | 7727-54-0 | |
| Bisacrylamide | Merk | 110-26-9 | |
| Chiaro nanoindenter | Optics 11 Life | no catologue number | |
| Ethanol | general | ||
| Fetal bovine serum | Gibco | 16140071 | |
| High glucose DMEM | Gibco | 11995065 | |
| Isopropanol | general | ||
| Kimwipe | Kimberly Clark | 21905-026 | |
| Microscope glass slides | VWR | 631-1550P | |
| MilliQ system | Merk Millipore | ZR0Q008WW | |
| OP1550 Interferometer | Optics11 Life | no catalogue number | |
| Optics 11 Life probe (k = 0.02-0.005 N/m, R = 3-3.5 um) | Optics 11 Life | no catologue number | |
| Optics 11 Life probe (k = 0.46-0.5 N/m, R = 50-55 um) | Optics 11 Life | no catologue number | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| RainX rain repellent | RainX | 26012 | |
| Standard petri dishes (90 mm) | Thermo Scientific | 101RTIRR | |
| Tetramethylethylenediamine | Sigma-Aldrich | 110-18-9 | |
| Vaccum dessicator | Thermo Scientific | 531-0250 | |
| Software | |||
| Data acquisition software (v 3.4.1) | Optics 11 Life | ||
| GitHub Desktop (Optional) | Microsoft | ||
| Python 3 | Python Software Foundation | ||
| Visual Studio Code (Optional) | Microsoft |
Referanslar
- Discher, D. E., Janmey, P. Y. W. Tissue cells feel and respond to the stiffness of their substrate. Science. 310 (5751), 1139-1143 (2005).
- Roca-Cusachs, P., Conte, V., Trepat, X. Quantifying forces in cell biology. Nature Cell Biology. 19 (7), 742-751 (2017).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature. Reviews. Materials. 5, 351-370 (2020).
- Moeendarbary, E., Harris, A. R. Cell mechanics: Principles, practices, and prospects. Wiley Interdisciplinary. Reviews. Systems. Biology and Medicine. 6 (5), 371-388 (2014).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: Forcing tumour progression. Nature Reviews Cancer. 9 (2), 108-122 (2009).
- Kubánková, M., et al. Physical phenotype of blood cells is altered in COVID-19. Biophysical Journal. 120 (14), 2838-2847 (2021).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- Ciccone, G., et al. What caging force cells feel in 3D hydrogels: A rheological perspective. Advanced Healthcare Materials. 9 (17), 2000517 (2020).
- Wu, P. H., et al. A comparison of methods to assess cell mechanical properties. Nature Methods. 15 (7), 491-498 (2018).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of young's modulus for soft biological tissues. Tissue Engineering B Reviews. 17 (3), 155-164 (2011).
- Humphrey, J. D., Delange, S. L. . An Introduction to Biomechanics Solids and Fluids, Analysis and Design. , 271-371 (2004).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: an emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. 1, 41-57 (2019).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Gavara, N. A beginner's guide to atomic force microscopy probing for cell mechanics. Microscopy Research and Technique. 80 (1), 75-84 (2017).
- Whitehead, A. J., Kirkland, N. J., Engler, A. J. Atomic force microscopy for live-cell and hydrogel measurement. Methods in Molecular Biology. 2299, 217-226 (2021).
- Chavan, D., et al. Ferrule-top nanoindenter: An optomechanical fiber sensor for nanoindentation. The Review of Scientific Instruments. 83 (11), 115110 (2012).
- Van Hoorn, H., Kurniawan, N. A., Koenderink Ac, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12 (12), 3066-3073 (2016).
- Baldini, F., et al. Biomechanics of cultured hepatic cells during different steatogenic hits. Journal of the Mechanical Behavior of Biomedical Materials. 97, 296-305 (2019).
- Emig, R., et al. Piezo1 channels contribute to the regulation of human atrial fibroblast mechanical properties and matrix stiffness sensing. Cells. 10 (3), 663 (2021).
- Dobre, O., et al. A hydrogel platform that incorporates laminin isoforms for efficient presentation of growth factors - Neural growth and osteogenesis. Advanced Functional Materials. 31 (21), 2010225 (2021).
- Antonovaite, N., Beekmans, S. V., Hol, E. M., Wadman, W. J., Iannuzzi, D. Regional variations in stiffness in live mouse brain tissue determined by depth-controlled indentation mapping. Scientific Reports. 8 (1), 12517 (2018).
- Wu, G., Gotthardt, M., Gollasch, M. Assessment of nanoindentation in stiffness measurement of soft biomaterials: kidney, liver, spleen and uterus. Scientific Reports. 10 (1), 18784 (2020).
- Lüchtefeld, I., et al. Elasticity spectra as a tool to investigate actin cortex mechanics. Journal of Nanobiotechnology. 18 (1), 147 (2020).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Blumlein, A., Williams, N., McManus, J. J. The mechanical properties of individual cell spheroids. Scientific Reports. 7 (1), 7346 (2017).
- Mirsandi, H., et al. Influence of wetting conditions on bubble formation from a submerged orifice. Experiments in Fluids. 61, 83 (2020).
- Vassalli, M., Ciccone, G. . CellMechLab/NanoPrepare: v0.1.1. Zendo. , (2021).
- Vassalli, M., Ciccone, G., Lüchtefeld, I. CellMechLab/nanoindentation: v1.0.0. Zendo. , (2021).
- Savitzky, A., Golay, M. J. E. Smoothing and differentiation of data by simplified least squares procedures. Analytical Chemistry. 36 (8), 1627-1639 (1964).
- Schafer, R. W. What is a savitzky-golay filter. IEEE Signal Processing Magazine. 28 (4), 111-117 (2011).
- Gavara, N. Combined strategies for optimal detection of the contact point in AFM force-indentation curves obtained on thin samples and adherent cells. Scientific Reports. 6, 21267 (2016).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2007).
- Virtanen, P., et al. SciPy 1.0: fundamental algorithms for scientific computing in Python. Nature Methods. 17 (3), 261-272 (2020).
- Tse, J. R., Engler, A. J. Preparation of hydrogel substrates with tunable mechanical properties. Current Protocols in Cell Biology. , (2010).
- Pharr, G. M., Oliver, W. C., Brotzen, F. R. On the generality of the relationship among contact stiffness, contact area, and elastic modulus during indentation. Journal of Materials Research. 7 (3), 613-617 (1992).
- Kumar, R., Saha, S., Sinha, B. Cell spread area and traction forces determine myosin-II-based cortex thickness regulation. Biochimica et Biophysica Acta - Molecular Cell Research. 1866 (12), 118516 (2019).
- Kunda, P., Pelling, A. E., Liu, T., Baum, B. Moesin controls cortical rigidity, cell rounding, and spindle morphogenesis during mitosis. Current Biology: CB. 18 (2), 91-101 (2008).
- Allen, M., Poggiali, D., Whitaker, K., Marshall, T. R., Kievit, R. A. Raincloud plots: a multi-platform tool for robust data visualization. Wellcome Open Research. 4, 63 (2019).
- Clark, A. G., Paluch, E. Mechanics and regulation of cell shape during the cell cycle. Results and Problems in Cell Differentiation. 53, 31-73 (2011).
- Langan, T. J., Rodgers, K. R., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 1524, 97-105 (2017).
- Hodgkinson, T., et al. The use of nanovibration to discover specific and potent bioactive metabolites that stimulate osteogenic differentiation in mesenchymal stem cells. Science Advances. 7 (9), 7921 (2021).
- Kloxin, A. M., Kloxin, C. J., Bowman, C. N., Anseth, K. S. Mechanical properties of cellularly responsive hydrogels and their experimental determination. Advanced Materials (Deerfield Beach, Fla). 22 (31), 3484-3494 (2010).
- Loessner, D., et al. Functionalization, preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nature Protocols. 11 (4), 727-746 (2016).
- Yue, K., et al. Synthesis, properties, and biomedical applications of gelatin methacryloyl (GelMA) hydrogels. Biomaterials. 73, 254-271 (2015).
- Sarrigiannidis, S. O., et al. A tough act to follow: collagen hydrogel modifications to improve mechanical and growth factor loading capabilities. Materials Today. Bio. 10, 100098 (2021).
- Karoutas, A., et al. The NSL complex maintains nuclear architecture stability via lamin A/C acetylation. Nature Cell Biology. 21 (10), 1248-1260 (2019).
- Ryu, H., et al. Transparent, compliant 3D mesostructures for precise evaluation of mechanical characteristics of organoids. Advanced Materials (Deerfield Beach, Fla). 33 (25), 2100026 (2021).
- Carvalho, D. T. O., Feijão, T., Neves, M. I., Da Silva, R. M. P., Barrias, C. C. Directed self-assembly of spheroids into modular vascular beds for engineering large tissue constructs Biofabrication Directed self-assembly of spheroids into modular vascular beds for engineering large tissue constructs. Biofabrication. 13 (3), 035008 (2021).
- Chaudhuri, O., Cooper-White, J., Janmey, P. A., Mooney, D. J., Shenoy, V. B. Effects of extracellular matrix viscoelasticity on cellular behaviour. Nature. 584 (7822), 535-546 (2020).
- Cantini, M., Donnelly, H., Dalby, M. J., Salmeron-Sanchez, M. The plot thickens: The emerging role of matrix viscosity in cell mechanotransduction. Advanced Healthcare Materials. 9 (8), 1901259 (2020).
- Elosegui-Artola, A. The extracellular matrix viscoelasticity as a regulator of cell and tissue dynamics. Current Opinion in Cell Biology. 72, 10-18 (2021).
- Chaudhuri, O. Viscoelastic hydrogels for 3D cell culture. Biomaterials Science. 5 (8), 1480-1490 (2017).
- Nguyen, T. D., Gu, Y. Determination of strain-rate-dependent mechanical behavior of living and fixed osteocytes and chondrocytes using atomic force microscopy and inverse finite element analysis. Journal of Biomechanical Engineering. 136 (10), 101004 (2014).
- Mokbel, M., Hosseini, K., Aland, S., Fischer-Friedrich, E. The Poisson Ratio of the Cellular Actin Cortex Is Frequency Dependent. Biophysical Journal. 118 (8), 1968-1976 (2020).
- Javanmardi, Y., Colin-York, H., Szita, N., Fritzsche, M., Moeendarbary, E. Quantifying cell-generated forces: Poisson's ratio matters. Communications Physics. 4, 237 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır